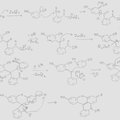
1ère ligne; 2em section : La présence de ZnCl2 (putain j'avais oublié, oublié ! c'est un affront ! que ZnCl2 se complexé avec les carbonyles…) permet d'avoir un Oxygène qui réagisse comme ça ? +O#C-R ?
Regarde l'acylation Friedel-Crafts, c'est exactement ce qu'on a si on remplace leur AlCl3 par ZnCl2 et leur X- par le COO- de notre anhydride phtalique. 
2ème ligne tout à droite : Le carbocation devrait être plan je crois bien.
Si tu veux, perso j'oriente mes groupes fonctionnels pour que ce soit lisible et que mes flèches ne fassent pas de sacs de noeuds…
3em ligne; 1ère section : Il te manque un énol sur ton cycle aromatique je crois bien.
Oups! Bien vu, merci. 
Au final, la solution m'est venue quand j'ai essayé de faire la forme lactone (ligne 4, molécule 1) plutôt que la forme finale: j'ai compris que l'alcool tertiaire (ligne 3, molécule 2) finissait dans le produit alors qu'avant j'essayais de l'éliminer…
Par contre je suis un peu sceptique pour la condensation des 2 phénols… Mais bon je vois pas d'autre solution et je suppose que ZnCl2 peut aider d'une manière ou d'une autre…

 Je vais tenter le coup dans mon coin…
Je vais tenter le coup dans mon coin…


 J'aime.
J'aime.