Coucou tout le monde,
Me revoici penché sur de la chimie, enfin !
Dans le cadre de l’étude de synthèse du Cis-platine (et même son mode d’action). Je remarque qu’on transforme le tetrachloroplatinate $[PtCl_4]^{2-}$ en tetraiodoplatinate $[PtI_4]^{2-}$ jusque là, rien d’anormale, on joue sur l’excès du sel d’halogonure de potassium en solution.
Puis une transformation plus sélective s’en suit :
$[PtI_4]^{2-} + NH_3 \longrightarrow [(H_3N)PtI_3]^{-} + I^-$
$[(H_3N)PtI_3]^{-} + NH_3 \longrightarrow [(H_3N)_2PtI_2] + I^-$
Je décide de noter comme ça le complexe ainsi formé, car les deux ammine (ligands) sont du même coté. D’où l’appellation CIS-platine.
Mais pourquoi diable l’amine se met tel a coté de son homologue ?
Mon hypothèse serait que la trans-halogénation sert a placer des halogènes de grosse taille, le rayon de l’iode est beaucoup plus grand que celui de l’ammoniac. Du coups lors du deuxième placement de l’azote, il aura plus de liberté près du premier azote qu’entouré de deux gros gaillard que sont les iodes en diagonales.
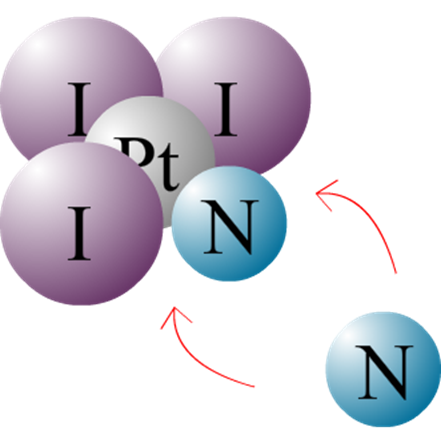
Je sollicite donc votre approbation ou votre contre-argumentaire pour m’aiguiller ^^. Merci pour le temps accordé à la lecture du post, Bon dimanche !

