À qui est destiné ce cours ? Il est destiné aux personnes ayant un minimum de bagage en chimie inorganique, notamment les notions de bases en oxydo-réduction. Aucun tutoriel sur Zeste de Savoir n'intègre de pré-requis pour ce contenu.
Au cours de votre scolarité, si vous êtes scientifique, vous entendrez souvent parler d'oxydo-reduction (réaction jumelée entre un oxydant (comburant) et un réducteur (combustible)).
Pour mieux comprendre ce qui arrive lors de ces réactions (quelle espèce est oxydante, quels sont les critères…) il est nécessaire d'avoir une vue d'ensemble sur ce qu'on appelle le nombre d'oxydation.
Que vous soyez adepte de chimie organique ou inorganique il sera nécessaire de déterminer ces indices d'oxydations.
La polarisation d'une liaison
Préambule, bien comprendre
Définition
Le Nombre d'Oxydation (ou Degré d'Oxydation, voir Indice d'Oxydation) est la description de la charge d'un atome. En somme, un atome possède un nombre d’électrons théorique, de manière à ce que la somme des charges positives (dans le noyau atomique, protons) et des charges négatives (électrons en périphérie de l'atome) soit égale à zéro.
Ce principe d’électroneutralité est global et ne renseigne donc pas sur la « distribution » des électrons au sein d'une molécule complexe (car il y a en effet des parties d'une molécule où l'on observe plus d'électrons que d'autres).
Nous savons par exemple que dans une liaison polarisée, les électrons sont plus proches de l'élément électronégatif (électro-attracteur). Le nombre d'oxydation d'un atome s'applique à donner cet ordre d'idée, bien que ce chiffre soit abstrait.
Tout commence par l'analyse structurale
L'analyse structurale de votre molécule (qu'elle soit ionique ou non), c'est le recensement des liaisons diverses, et des atomes au sein d'une molécule, quant à leurs agencements et quant à leurs multiplicités de liaisons.
Un nombre d'oxydation s'affecte à un élément chimique seulement. Nous ne pouvons pas appliquer la notion de nombre d'oxydation à des molécules entières. Nous devons nous intéresser à chaque élément individuellement.
Comment comprendre une formule ?
Le dioxyde de carbone pour commencer
Évaluer le nombre d'oxydation équivaut à se renseigner sur les charges partielles contenues dans une molécule. Essayons d'analyser la polarité des liaisons de la molécule de dioxyde de carbone :
Pour connaître la polarisation des liaisons de cette molécule il faut nous concentrer sur l’électronégativité des atomes relatifs.
- L'oxygène ($\mathrm {O}$) : 3.44
- Le carbone ($\mathrm {C}$) : 2.55
L'oxygène est donc ici l’élément attracteur d'électrons (son électronégativité est plus grande que celle du carbone). Nous savons donc que le nuage électronique de la liaison est plus proche du noyau de l'oxygène. Nous obtenons alors les charges partielles suivantes :
Certains scientifiques n'aiment pas la notion de « charges partielles multiples ». Ainsi le $\delta^{2+}$ peut être pris pour un excès de zèle ou une informalité. Il est donc préférable lors de l'utilisation des charges partielles, en examen, que vous vous soyez mis en accord avec votre professeur ou correcteur.
Première étape - Quelles sont les espèces
Comptons alors le nombre de liaisons dans cette molécule :
- L'oxygène fait 2 liaisons avec le carbone.
- Le carbone fait 4 liaisons avec des oxygènes.
- L'oxygène terminal fait 2 liaisons avec le carbone.
Deuxième étape - Comment sont organisées les charges
Le but maintenant est d'appliquer au précédent listing un chiffre relatif (positif ou négatif), qui correspond à la charge partielle de l'atome étudié à chaque point.
L'oxygène compte donc, pour le carbone, 2 charges partielles négatives ce qui signifie que son nombre d'oxydation est de -2 noté en chiffre romain : $\mathrm{-II}$.
Rappel : car il possède 2 liaisons relatives au carbone et que l'oxygène est plus électronégatif que ce dernier ($3.44 > 2.55$).
L'atome d'oxygène fait 2 liaisons avec le carbone, il est normal que son nombre d'oxydation soit de -2.
Nous savons que les oxygènes sont au nombre de deux, donc ce nombre est attribué de part et d'autre de la molécule :
Comment deviner le nombre d'oxydation du carbone alors ?
En sachant que la globalité de la molécule est neutre, nous pouvons comprendre qu'il y a autant de charge positive que négative. Cela doit être clair, lorsque nous étudions un élément chimique pour en connaitre le nombre d'oxydation, et qu'il est neutre (comme ici, le carbone ne porte pas de charge réelle) alors l'équation est égale à 0 pour représenter la neutralité de l’élément.
Nous avons finalement ceci :
Nous savons désormais que l'état d'oxydation/nombre d'oxydation du carbone contenu dans le $CO_2$ est de $\mathrm{+IV}$.
D'autres exemples, histoire de s'entretenir
Ah c'est déjà pas mal non ? 
Je sens que nous allons nous ennuyer si nous ne prennons pas une plus grosse molécule tout de suite  . Alors je vous propose d’étudier les atomes de cette molécule :
. Alors je vous propose d’étudier les atomes de cette molécule :
$\chi _{F} = 3.98$
$\chi _{S} = 2.58$

A noter que l'hexafluorure de soufre possède un nom qui donne un indice direct. $\mathrm{Fluorure = fluor\;négatif = F^{-}}$. Nous savons aussi que le fluor est l’élément le plus électronégatif de tous ! Nous pourrons supposer facilement que le nombre d'oxydation du soufre ($\mathrm{n.o. (S)}$) sera positif.
$\mathrm{n.o. (F) = -I}$
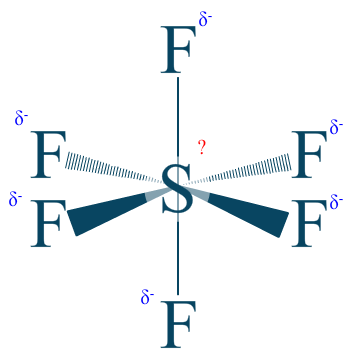
Rappel : l'équation est égale à 0 car la charge de la molécule finale est neutre.
Ils sont au nombre de 6 :

A retenir pour s'en servir
Pour se servir de cette méthode le plus intelligemment possible, il faudrait se rappeler que le nombre d'oxydation le plus grand d'un couple (nombre d'oxydation appartenant à l’élément principal ($\mathrm{Cr}$, $\mathrm{Mn}$, $\mathrm{S}$…)) est l'oxydant ! Tel que $\mathrm{Mn^{+VII}}$ est l'oxydant du couple $\mathrm{Mn^{+VII}/Mn^{+IV}}$ car $7 > 4$.
Rappel : un couple redox s'écrit $\mathrm{Ox/Red}$
Attaquons-nous aux ions !
Les oxydes de manganèse
Ces oxydes étant couramment étudiés en chimie inorganique (en réaction redox) nous allons nous entraîner à ce propos, histoire d'avoir une petite préparation adaptée.
Couple n°1 $\mathrm{KMnO_4/MnO_2}$
Alors, dans le cas de l'ion permanganate $\mathrm{MnO_{4}^{-}}$ nous avons cette formule :
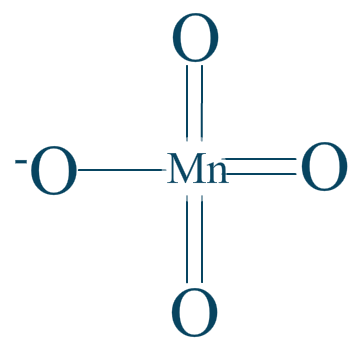
Nous récapitulons 7 liaisons polarisées : 3 doubles et 1 simple.
$\chi _{O} = 3.44$
$\chi _{Mn} = 1.55$
Les métaux seront toujours très électropositifs ! Même les hydrogènes et les carbones seraient négatifs face aux métaux. (cf. carbures/hydrures)
Nous pouvons considérer l'état d'oxydation des 4 oxygènes comme $\mathrm{-II}$ tout autour de la molécule, mais tout en sachant qu'il n'y a qu'une liaison de l'oxygène négatif qui entre réellement en compte ! Nous aurions alors le résultat suivant :
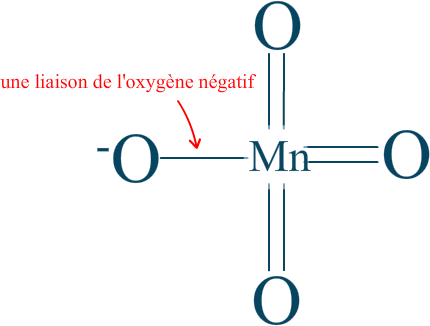
Nous voilà avec le nombre d'oxydation du manganèse dans l'ion permanganate. $\mathrm{n.o. (Mn) = +VII}$
Et pour le dioxyde de manganèse ?
Pour lui, nous avons un comportement similaire à celui de $\mathrm{CO_{2}}$. Nous avons donc un couple que que nous pouvons résumer tel que :
Et nous avons bien le plus oxydé avant le moins oxydé ($7 > 4$).
Couple n°2 $\mathrm{KMnO_4/K_2MnF_6}$
Dans ce cas présent nous nous occupons de l'ion hexafluorure de manganèse $\mathrm{MnF_{6}^{2-}}$ dont nous avons la formule suivante :
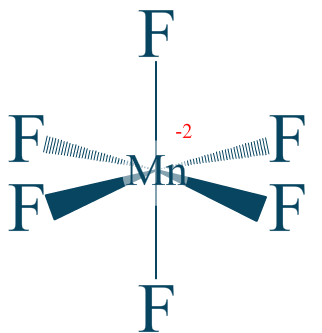
Nous comptabilisons alors 6 liaisons polarisées.
$\chi _{F} = 3.98$
$\chi _{Mn} = 1.55$
Nous obtenons un manganèse $\mathrm{+IV}$.
Avec $\mathrm{n.o. (Mn) = +IV}$
Rappel : nous étudions le couple $\mathrm{MnO_4^-/MnF_6^{2-}}$
Avec le permanganate de manganèse (que nous avons vu juste précédemment), nous avons un couple que l'on peut résumer ainsi :
Qui est semblable au précédent couple étudié (Permanganate/Dioxyde).
À noter que la forme $\mathrm{MnF_6^{2-}}$ est en équilibre avec la forme $\mathrm{MnF_4}$ où le manganèse a un indice d'oxydation de $\mathrm{n.o. (Mn) = +IV}$.
Oxyde de soufre, vous allez souffrir muahahhaa…
Un sulfite et vite
Ces ions soufrés sont aussi couramment rencontrés en étude de réactions redox. Je commence par un avertissement :
Lorsqu'il y a plusieurs soufres dans un ion, il est fréquent de voir des ponts disulfures apparaître $\mathrm{R-S-S-R}$ lorsque les oxygènes sont en nombre pair.
Étudions l'ion sulfite $SO_{3}^{2-}$, qui possède cette formule :
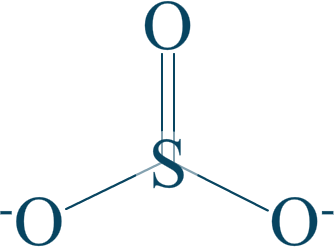
Votre œil avisé remarquera aisément que $\mathrm{n.o. (S) = +IV}$.
Son copain malin le tétrathionate
Nous abordons abruptement le tétrathionate car il possède une particularité toute singulière que vous rencontrerez surement souvent. De plus, cet ion appartient à un couple sulfite/tétrathionate.
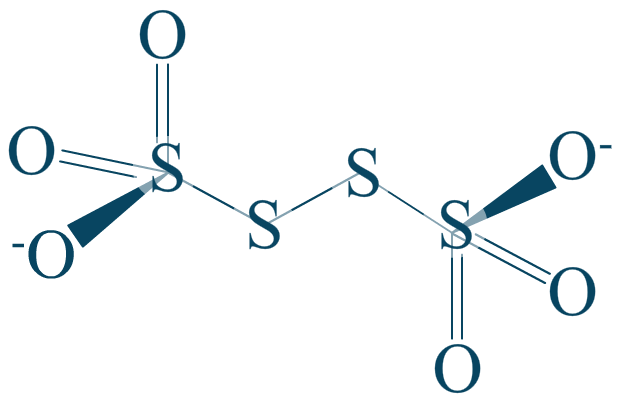
Comment calculer le nombre d'oxydation du soufre, quand il est lui même relié à un soufre ?
Rappelons l'étape primaire qui consistait à prendre en compte les liaisons polarisées. Ici, la liaison $\mathrm{S-S}$ ne peut pas être polarisée car elle est située entre deux atomes d'électronégativité strictement identique. Ce qui signifie que la liaison n'entre pas dans les calculs.
Bon, en réalité le soufre extrémal est plus attracteur que le soufre central car les oxygènes à sa périphérie sont inductifs attracteurs sur une longueur pouvant être de 3 atomes ! Ici, ces effets sont négligés volontairement car, rappelons-le, le nombre d'oxydation est une valeur abstraite.
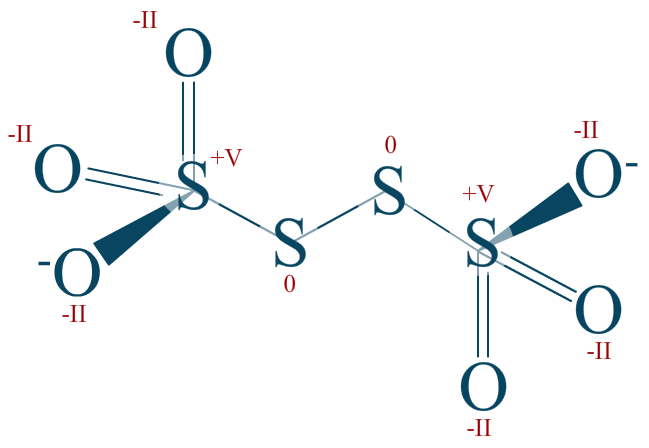
Les soufres extrémaux font 5 liaisons polarisées et une liaison strictement covalente. Ce qui explique pourquoi $\mathrm{n.o. (S) = +V}$.
Rappel : la totalité de l'ion est chargée -2, ce qui s'explique par les nombres d'oxydations.
Nous supposerons dorénavant que les molécules courantes ainsi que les cas un peu plus surprenants ont été vus. Il est maintenant temps pour vous de passer à l'étape des exercices. Le cours n'est pas fini mais à partir de là, c'est totalement à vous de jouer.
Exerçons-nous avec ces indices d'oxydation
Exercice de type chimie inorganique
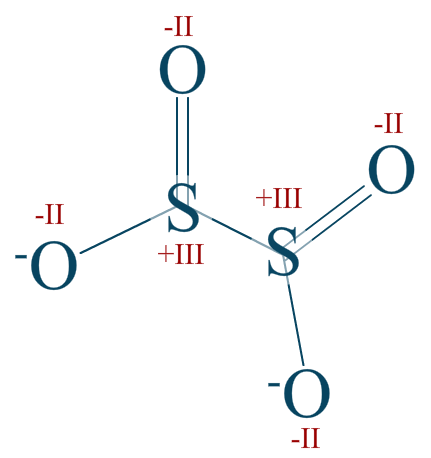
L'anion dithionite
Attribuez aux éléments de l'ion dithionite les indices d'oxydations qui leur sont propres.
Énoncé
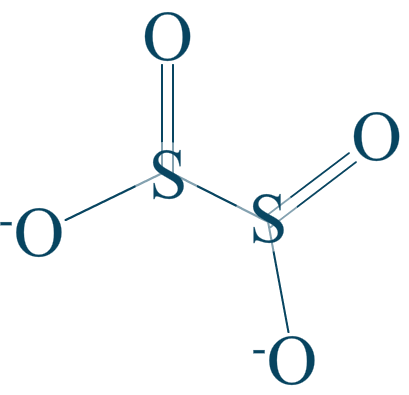
Données :
Réponse :
Le dioxyde de soufre
Attribuez aux éléments du dioxyde de soufre les indices d'oxydations qui leur sont propres.
Énoncé
Données :
Réponse :
Exercice de type chimie organique
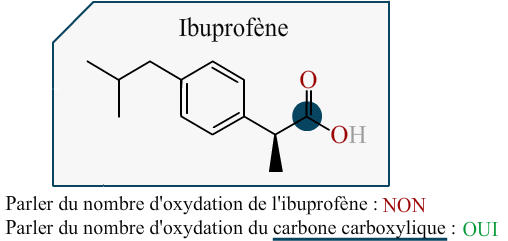
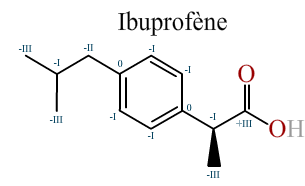
L'ibuprofène
Attribuez aux carbones de la molécule d'ibuprofène les indices d'oxydations qui leur sont propres.
Énoncé

Données :
Réponse :
La Brucine
Attribuez aux carbones de la molécule de brucine les indices d'oxydations qui leur sont propres.
Énoncé
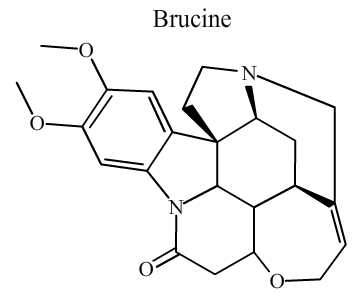
Données :
Indices :
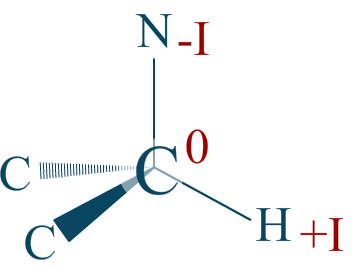
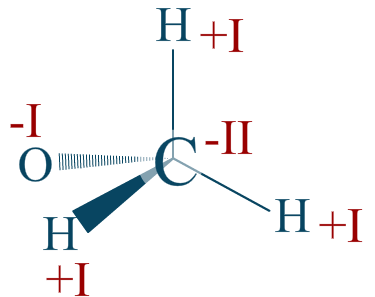
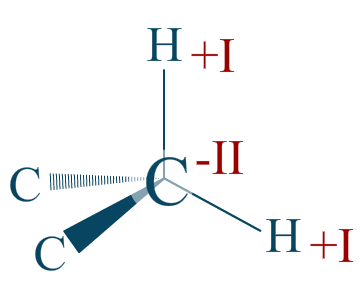
Réponse :

Voilà, ce tutoriel touche à sa fin. J'espère que cela aura permis de vous exercer tranquillement, tout en ayant une méthode « simple », qui devient vite intuitive je l'espère. Normalement, avec un petit peu d'entraînement tout vous sautera aux yeux plus facilement.
Je tiens à remercier GriffedeKoala pour m'avoir aidé dans la relecture orthographique de ce tutoriel.
Ainsi que Taurre qui s'est donné du mal pour que le tutoriel soit exact, aussi bien dans le fond que dans la forme.
Rédacteurs : Blackline, GriffedeKoala
Illustrateur : Blackline
Correcteur : GriffedeKoala
 Nombre d'oxydation
Nombre d'oxydation



