Bonjour à tous,
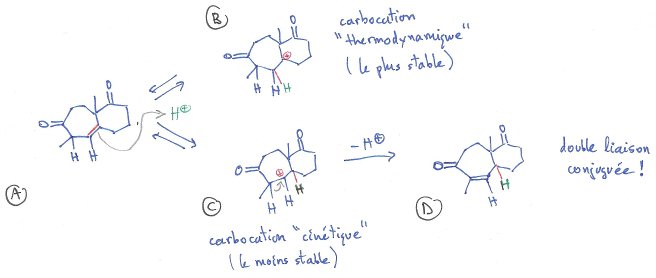
Voilà j'ai un souci concernant l'isomérisation acido-catalysée qui intervient au cours du passage entre C et D ( voir annexe) : http://zestedesavoir.com/media/galleries/1486/43319e5e-a71d-427c-8bd5-887c2f0ce2d3.jpg
Le prof me dit qu'il y a isomérisation de l'alcène par formation de l'intermédiaire carbocation et migration 1,2-d'hydrure (réarrangement de Wagner)pour passer de C à D. Ce type de réaction est une déprotection d'une fonction carbonyle, La fonction cétone a été protégée préalablement sous forme de cétal par action d'un excés l'éthylène glycol en catalyse acide (c'est un équilibre, réaction de cétalisation).
Et du coup je pense que ce que j'ai fait n'est pas du tout ça mais je ne vois pas comment faire en fait le mécanisme…
Merci d'avance pour votre aide. Cordialement.



 ! Moi le seul truc qu'on m'a dit c'est de réfléchir au réarrangement de Wagner…
! Moi le seul truc qu'on m'a dit c'est de réfléchir au réarrangement de Wagner…