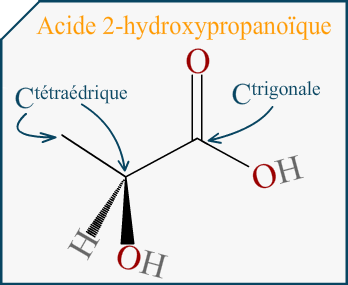
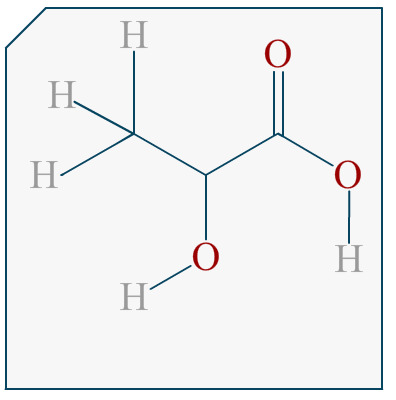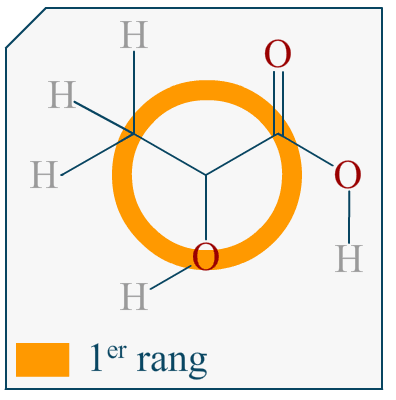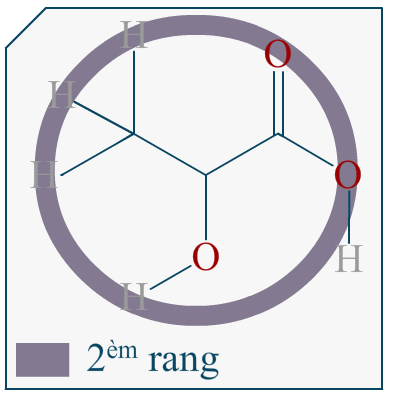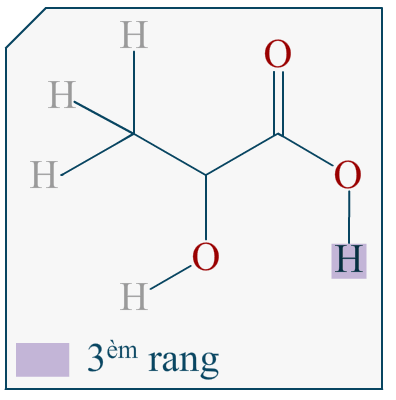
Bonjour,
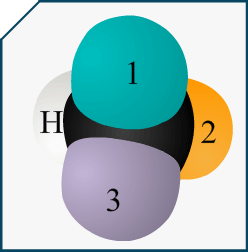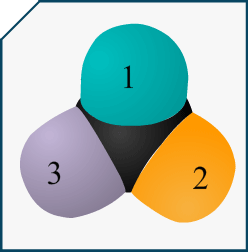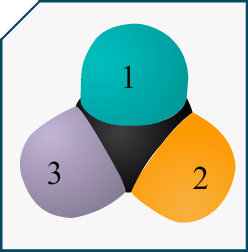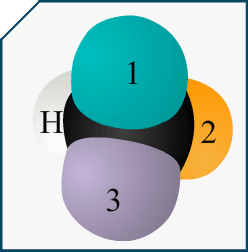
Si on me demande de représenter l’énantiomère d’une molécule en représentation de Cram et que cette molécule est représentée dans l’énoncé avec sa formule topologique, comment puis-je savoir quelle liaison va devant et derrière le plan?
Merci bien.
+0
-0