Bien que régulièrement enseigné dans le supérieur, le domaine aujourd’hui connu sous le nom de thermodynamique reste généralement mal compris par le grand public. Pourtant, ses concepts sont transversaux en physique moderne, et ses applications s’étendent de l’étude des propriétés fondamentales des gaz à la réalisation de machines industrielles. Ce tutoriel vise à présenter deux notions fondamentales utilisées en thermique, et souvent confondues : la notion de température et celle de chaleur.
Pour suivre ce tutoriel, seules des notions très rudimentaires de mathématiques et de physique sont nécessaires. L’ambition de cette introduction est qu’elle puisse être comprise par quelconque personne ayant réussi à accéder à ce tutoriel par ses propres moyens. Si vous êtes ici, bonne nouvelle : vous pourrez sans doute comprendre les notions abordées. Cet avertissement ne devrait par ailleurs probablement pas décourager des personnes plus avancées dans leur compréhension de la physique : sur un échantillon de dix étudiants ayant étudié la thermique, il est probable qu’un ou deux au plus soient à l’aise pour en expliquer les concepts rudimentaires.
Les puristes de la terminologie trouveront dans ce tutoriel quelques points de détail pouvant les effrayer. En particulier, dans cette introduction, j’emploierai de manière interchangeable les notions de thermique et de thermodynamique. Cette distinction prend son importance dans l’étude de phénomènes poussés, mais autant que cela nous concerne, la distinction entre les deux domaines est ténue, si ce n’est inexistante. De même, la définition de certaines unités a été simplifiée pour rendre le contenu pédagogique ; pour ces quelques cas, une note précise au lecteur la nature réelle de l’unité manipulée.
- La température : un concept naturel
- Évolution des températures : les échanges de chaleur
- Mécanismes des transferts thermiques
La température : un concept naturel
Avant le XVIIIe siècle, les phénomènes thermiques étaient généralement mal expliqués, du fait d’une confusion constante entre deux notions pourtant bien différentes : la notion de température et celle de chaleur. La distinction claire entre ces deux concepts n’est pas évidente à comprendre au premier abord, mais marque une rupture franche dans la description de la thermodynamique 1.
Notion de température
La température est une notion naturelle pour la plupart d’entre nous, car nous naissons dans un monde où les mesures de température sont omniprésentes, et très habituelles : température de l’eau à ébullition pour la cuisson des aliments, prévision météorologiques, etc. On est d’ailleurs en mesure, a priori, de ranger un ensemble de corps solides par ordre de températures croissantes par le simple sens du toucher. Pourtant, ce constat n’est pas si certain : en considérant une balle de fer et une balle de bois à températures égales, la balle de fer nous semble plus froide que la balle en bois. Il s’avère donc que nos sens ne sont donc pas de bons thermomètres : il est nécessaire de considérer des notions plus tangibles pour la mesure de températures.
Physiquement, une manifestation importante de la température s’observe à travers les changements d’état : au-dessous d’une certaine température, un corps est solide, au-delà d’une certaine température il est gazeux. Les changements d’état des corps sont rappelés sur l’image ci-dessous, et il est intéressant de connaître ces différentes transformations. En particulier, la définition des échelles de températures était originellement basée sur les différents changements d’état de l’eau, et l’existence des états de la matière garde une importance capitale dans la définition des unités modernes.
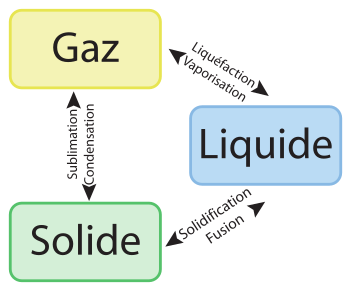
Par ailleurs, en mettant en contact un corps chaud et un corps froid, nous constatons qu’au bout d’un certain temps, le corps chaud et le corps froid arrivent à une même température. Il est même possible d’affirmer — et facile de constater — que le corps chaud se refroidit et que le corps froid se réchauffe. Ce constat expérimental ne saurait être expliqué au sens de la physique phénoménologique, il doit ainsi être considéré comme un principe, le principe zéro de la thermodynamique.
Deux corps placés en contact prolongé se mettent en équilibre thermique. Autrement dit, ils atteignent une température identique au bout d’un certain temps.
Fixation d’une échelle
La définition de la température via un simple ressenti n’est, comme illustré plus haut, pas suffisante pour une étude physique. Le principe zéro, en revanche, nous fournit une arme puissante pour la réalisation de thermomètres, soit de capteurs de température, puisque le thermomètre finira par prendre, au bout d’un certain temps, la température du corps avec lequel il est mis en contact.
La possibilité d’obtention d’une représentation de la température d’un objet étant posée via le principe zéro, il est possible de définir une échelle de température. La définition de l’échelle garde toutefois une part d’arbitraire, puisque nous devons choisir des points de référence, que l’on appelle points fixes, pour la détermination de cette échelle. Cette notion d’arbitraire dans la fixation d’une échelle est fondamentale à comprendre : il n’existe pas de règle naturelle permettant de mettre un nombre sur une température. Pour obtenir une échelle, il faut fixer deux points de référence.
Prenons par exemple l’échelle Celsius de température, très utilisée en France. Cette échelle fixe comme repère la température de fusion de la glace à sous pression atmosphérique, et la température d’ébullition de l’eau liquide à . Elle divise donc en cent parts la température de l’eau à l’état liquide sous pression atmosphérique.
La connaissance de ces deux points de référence est en soi suffisante, mais quelque peu abstraite. Il est possible de se représenter la température par le principe des thermomètres à alcool — autrefois thermomètres à mercure. Le principe d’un thermomètre est de convertir une température, autrement dit une grandeur que nos sens parviennent difficilement à quantifier précisément, en une distance, que l’on perçoit immédiatement à l’œil.
Pour la fixation de la distance entre les différentes graduations de l’échelle Celsius, on peut montrer qu’une très bonne approximation est de considérer une variation linéaire de la température en fonction du volume du liquide, c’est-à-dire que pour toute augmentation de température d’un degré, le volume du liquide augmentera d’une quantité fixe. Dans un tube de section constante, une augmentation d’un degré augmentera donc la distance à l’origine du tube d’une quantité fixe.
Nous avons ici appelé « échelle Celsius » l’échelle historique de température, utilisée dans ce cours. Il convient de noter que cette échelle est normalement appelée échelle « Centigrade », mais nous sommes moins habitués à ce terme. Quelques différences techniques, que nous ne détaillerons pas ici, font que la définition formelle de l’échelle Celsius en physique est différente de celle proposée dans ce cours.
Généralement, l’échelle Celsius est peu naturelle dans l’étude des phénomènes physiques, et on lui préfère le plus souvent l’échelle kelvin. Cette échelle est similaire en variation : pour une élévation d’un degré Celsius se produit une élévation d’un kelvin. Elle n’est toutefois pas similaire pour son zéro : le zéro de l’échelle Celsius correspond à la température de fusion de la glace, tandis que le zéro de l’échelle kelvin correspond au zéro absolu, à 2.
Le zéro absolu est un concept difficile à définir en première approche. Formellement, il correspond à la température pour laquelle l’agitation thermique des molécules est nulle. Concrètement, bien que les molécules nous semblent fixes, elles réalisent en réalité de petites variations aléatoires autour d’une position moyenne. L’amplitude de ces variations augmente à mesure que la température augmente. Le zéro absolu correspond au point pour lequel plus aucun mouvement n’est observable.
- Brenner, A., & Boudot, M. (1990). Les enjeux philosophiques de l’énergétisme. Dans Duhem : Science réalité et apparence (p. 62‑88). Librairie philosophique J. Vrin. (ISBN 978–2-7116–1004–4)↩
- Bureau International des Poids et Mesures (BIPM). (2014). Unit of thermodynamic temperature (Kelvin). BIPM. Consulté en février 2022.↩
Évolution des températures : les échanges de chaleur
En complément de la notion de température se trouve le concept de chaleur, que nous allons tenter de détailler par une approche simple et intuitive. La différence fondamentale entre ces deux concepts se trouve dans le fait que la chaleur caractérise la grandeur échangée entre deux corps, tandis que la température est une mesure de la propension des corps à réaliser cet échange.
Unités et système international
Les unités thermiques étaient jusqu’à très récemment, et sont parfois toujours, très diverses, et peu unifiées selon les ouvrages. Bien qu’ait été opérée une normalisation des unités par le Système International, de nombreuses autres unités restent d’usage courant, car elles présentent un lien fort avec la réalité physique. Nous utiliserons ici autant que possible les unités du Système International. Une exception sera faite, dans l’optique de rendre le cours plus pédagogique, il s’agit de l’unité de calorie thermique, que nous allons utiliser dans ce chapitre. Cette unité est confondante en cela qu’on distingue la petite calorie de la grande calorie. Pour ne pas embrouiller le lecteur, seule la petite calorie sera retenue, et définie comme :
Une calorie, ou petite calorie, est définie comme la quantité de chaleur nécessaire pour élever la température d’un gramme d’eau dégazée de à .
Cette définition peut sembler effrayante, mais se comprend assez bien : en prenant de l’eau à , et en la chauffant de un degré précisément, nous avons fourni à l’eau une calorie. C’est cette notion de fournir à l’eau une chaleur qui sera détaillée dans ce chapitre. Toutes les autres unités utilisées seront issues du Système International, comme le kelvin étudié ci-avant.
Capacité thermique
Imaginons qu’à un instant donné, nous mettions en contact deux corps de même nature et de même masse, mais à des températures différentes et 3. La température finale du système de deux corps vient naturellement, et correspond à la moyenne des températures des corps :
Bien évidemment, cette relation se généralise aux problèmes à corps, mais les conditions imposées sont restrictives, nous allons ainsi relâcher une à une les hypothèses. Commençons par étudier ce qu’il adviendrait de deux corps de masses différentes mis en contact thermique ; il semble logique que le corps le plus lourd impose sa température fermement au corps léger. Une expression adaptée serait :
Où et sont les masses respectives des corps en contact. Nous pouvons vérifier de cette relation que si un des deux corps présente une masse très supérieure à l’autre, alors la température finale sera très proche de celle du corps le plus lourd.
Les deux expressions obtenues ci-dessus pouvaient être comprises de manière intuitive très facilement, mais si l’on cherche comment obtenir la température finale issue de la mise en contact de deux corps de nature différente, on se heurte à un problème : nous ne disposons pas d’une information permettant de pondérer l’influence d’un corps par rapport à un autre. Il faut donc ici introduire une nouvelle grandeur, la capacité thermique du corps. Cette grandeur est un facteur donnant la prédisposition d’une espèce à échanger de la chaleur, et permet d’écrire la relation générale de mise en contact thermique :
Quantité de chaleur
Généralement, on préfère écrire l’équation de la température d’équilibre sous une autre forme. Considérons le problème de mise en contact thermique du point de vue des deux corps, et sans s’intéresser à la température obtenue à l’état final. On peut mettre l’expression obtenue ci-dessus sous la forme :
Prenons l’exemple dans lequel la température du corps 1 est plus grande que la température finale. Ainsi, du point de vue du corps 1, tout se passe comme s’il cédait une certaine quantité de chaleur ; ce terme sera négatif car on a . De même, du point de vue du corps 2 tout se passe comme s’il recevait une certaine quantité de chaleur ; ce terme sera positif car on a .
L’expression représente par définition la quantité de chaleur échangée par le corps avec les autres corps en présence. Le signe de est positif lorsque le corps reçoit de la chaleur, autrement dit lorsque sa température aura augmenté dans l’état final, et négatif dans le cas contraire.
Lors d’une mise en contact thermique, on peut alors dire que la somme algébrique des quantités de chaleurs des différents corps est nulle. Cet énoncé est formellement équivalent à l’expression de la température finale issue de la mise en contact des deux corps, et préféré des physiciens.
La quantité de chaleur s’exprime en calories2, on fixe alors la capacité thermique de l’eau liquide dans ce système d’unité à . Cette capacité thermique est dite massique, mais on trouve également des capacités thermiques volumiques, obtenues en multipliant la capacité massique par la masse volumique.
Chaleur latente
La chaleur — ou quantité de chaleur — vue ci-dessus est dite sensible : elle met en emphase la facilité d’un corps à faire changer sa température sans changement d’état, mais ne nous dit rien de la chaleur nécessaire pour réaliser un changement d’état. Prêtons-nous à une simple expérience de pensée : prenons de la glace, dont la température est de , et plaçons là en contact avec une source de chaleur.
La notion de source de chaleur semble évidente au premier abord, mais il est intéressant d’y apposer une définition claire. Concrètement, une source de chaleur est un milieu conservant une température donnée quelque soit l’objet avec lequel il est mis en contact. Autrement dit, la capacité thermique d’une source de chaleur doit être très grande devant les objets avec lesquels elle est susceptible d’être mise en contact.
La glace fond rapidement, mais imaginons qu’on fasse cesser la réaction avant que l’entièreté de la glace n’ait fondu. Il subsiste une partie de glace, en contact thermique avec l’eau. Ainsi, du point de vue de la thermique, l’eau liquide et la glace se trouvent toutes deux à la même température : .
En effet, imaginons que la température soit supérieure ; la glace ne peut subsister dans cet état à pression atmosphérique. De même, la température ne peut être inférieure, sans quoi l’eau liquide ne peut exister : la température d’un système coexistant dans deux états est ainsi fixée. Pourtant, notre intuition nous indique que quelque chose a bien changé lors de cette expérience : de la glace s’est liquéfiée.
Cette expérience nous illustre les limites de la chaleur sensible, et nous introduisons, afin d’expliquer ce que l’expérience met en exergue, une nouvelle notion, représentant la chaleur consommée par la glace pour former l’eau liquide, et ce sans changement de température. Cette quantité de chaleur est désignée sous le nom de chaleur latente1, et exprimée sous forme massique en ou volumique en .
Les notions de chaleurs spécifique et latente nous permettent de tracer sur la figure ci-dessous la température d’un corps en fonction de la quantité de chaleur fournie au corps. On note qu’à chaque changement d’état existe un plateau, correspondant à la transformation à température constante.

- On parle également d’enthalpie de changement d’état.↩
- Le premier principe de la thermodynamique montrera par la suite qu’on pourrait exprimer ces quantités de chaleur en joules.↩
- Bruhat, G., Kastler, A., & Vichnievsky, R. (1962). Notion de quantité de chaleur. Dans Cours de physique générale : Vol. Thermodynamique (5e éd., p. 15‑20). Masson et Cie.↩
Mécanismes des transferts thermiques
Jusqu’ici, nous nous sommes cantonnés à une étude purement statique des phénomènes d’origine thermique. Le principe zéro par exemple donne une loi d’équilibrage de la température au bout d’un certain temps, sans jamais préciser ce temps. L’étude de la thermocinétique, autrement dit de l’évolution des températures, est une discipline plus complexe, qui ne rentre pas dans le cadre de cette introduction. Sans rentrer dans le détail, il est toutefois intéressant d’avoir une idée de ces phénomènes, et de comment ceux-ci se manifestent dans la vie courante.

Contact direct de corps : la conduction
Un transfert thermique, soit un transfert d’une quantité de chaleur, peut présenter trois origines distinctes1. Le phénomène de propagation le plus simple à interpréter est celui de la conduction thermique ; il est si naturel qu’il est utilisé comme illustration depuis le début de ce cours. Lorsque l’on place deux corps en contact, et en supposant que ces deux corps ne se déforment pas, il n’y a pas de mélange entre les corps. L’apparence des corps est conservée, et la chaleur s’échange par elle-même, sans nécessiter de matière comme vecteur de transfert.
L’exemple typique de la conduction est la tasse remplie d’un liquide chaud : le liquide est à une température plus grande que la tasse, qui va se mettre progressivement à chauffer. Pourtant, on observe bien que le liquide ne se mélange pas avec la tasse, la propagation est alors essentiellement conductive. Le caractère statique de la mise en contact est important ici : aucun déplacement n’a lieu lors d’une conduction.
Interaction à distance : le rayonnement
La conduction explique la propagation de la chaleur dans les cas de contact direct entre deux corps. Pourtant, on observe qu’il fait toujours plus chaud devant une cheminée que dans le reste de la pièce, la chaleur doit donc pouvoir se transmettre par au moins un moyen à distance. Cette origine pour les transferts thermiques est difficile à envisager, car elle fait appel à une notion peu naturelle, celle de rayonnement. Comme la conduction, le rayonnement est une propagation sans transport de matière, mais contrairement à cette dernière, le rayonnement se propage à distance entre deux corps : aucun contact direct n’est nécessaire.
En conservant une approche classique, on peut considérer que les corps rayonnants émettent des ondes électromagnétiques, qui sont reçues par les corps alentours. Ces ondes sont émises dans toutes les directions, et correspondent à de la lumière, visible ou non. Plus la température augmente, plus la longueur d’onde diminue, il est ainsi possible d’observer à l’œil nu le rayonnement : lorsqu’un corps est chauffé à haute température, on observe qu’il semble changer de couleur, pour devenir rouge ; ce changement de couleur apparent est le résultat du rayonnement. Il est évident que la matière n’est pas déplacée par le rayonnement, les deux corps n’étant pas en contact direct, toute interaction à distance s’effectue nécessairement sans échange de matière.
Le rayonnement est un mode indirect de transfert de chaleur : il est incorrect de considérer que le corps chaud émet de la chaleur. Le corps chaud émet seulement du rayonnement, issu de sa température élevée, qui, reçu par le corps froid, se transforme en chaleur. En cela, en plus d’être le seul vecteur d’interaction calorifique à distance, le rayonnement n’impacte pas de manière égale tous les objets : certains corps sont plus susceptibles de recevoir le rayonnement — et de le convertir en chaleur — que d’autres.
Mouvement de fluides : la convection
Nous avons considéré deux cas pour la propagation de la chaleur : une interaction de contact et une interaction à distance. Ces deux interactions ont en commun qu’elle s’effectuent sans aucun déplacement de matière. Toutefois, la conduction, bien que naturelle pour le contact de solides, n’est pas le phénomène prépondérant pour l’homogénéisation de la température dans les fluides, où la propagation de la chaleur est causée par un déplacement de matière : on parle de convection.
La théorie complète de la convection est un problème en lien avec la dynamique des fluides, mais on peut noter simplement qu’on distingue deux types de convection : la convection naturelle, qui est engendrée uniquement par des différences de températures, en l’absence d’agitation extérieure, et la convection forcée, aidée par une cause externe, et indépendante du phénomène thermique. Les ventilateurs, par exemple, ou les pompes, créent des convections forcées, en contraignant selon une direction donnée un flux, respectivement d’eau et d’air.
Imaginons une casserole remplie d’eau, que l’on place sur une plaque chauffante ; la plaque transmet sa chaleur par conduction à la casserole, qui transmet par suite la chaleur à l’eau en fond de récipient. L’eau chaude au fond présente alors une densité plus faible que l’eau en surface, et un courant s’amorce, mélangeant les couches d’eau. Les phénomènes de conduction entre ces couches, et entre la casserole et l’eau vont alors avoir tendance, par suite, à homogénéiser la température au sein du récipient. Afin d’observer ces courants, on peut placer des petites particules dans le récipient contenant l’eau chauffée — des grains de riz par exemple. Les particules sont mises en mouvement du fond vers la surface par les courants de convection.
La conduction est un transfert de chaleur de contact (ou de proche en proche), qui s’effectue sans déplacement de matière, contrairement à la convection, également mode de contact, mais s’effectuant avec un déplacement de matière.
Séparation des phénomènes
Bien que les exemples imaginés dans ce tutoriel soient très compartimentés, afin d’illustrer les différents échanges, on observe dans le cas général que les trois phénomènes de propagation agissent simultanément, et la distinction est alors difficile. Dans l’exemple de la casserole, imaginons la plaque chauffante, dont nous n’avions pas précisé la nature, comme un réchaud au gaz. La transmission de la chaleur de la plaque au récipient s’effectue alors par conduction, mais également par rayonnement. Également, l’égalisation des températures dans l’eau est due en partie à une conduction entre les différentes couches de l’eau liquide.
L’exercice de la physique consiste à trouver le point pour lequel les phénomènes à l’œuvre sont considérés importants, relativement à la précision souhaitée sur le résultats : on part généralement du phénomène le plus important pour rajouter ensuite les contributions d’autres variables si nécessaire. Pour déterminer les phénomènes à prendre en compte, il est important de connaître les différentes caractéristiques de ces modes de propagation.
- Fabry, C. (1942). Introduction. Dans Propagation de la chaleur (p. 7–24). Librarie Armand Colin.↩
Ce tutoriel est désormais terminé ! Les notions de température et de chaleur, ainsi que la distinction entre ces deux concepts devrait désormais apparaître plus clair. L’introduction des différents types de transfert possibles : conduction, convection et rayonnement, ainsi que leurs caractéristiques, aura également permis d’illustrer via des situations simples les notions abordées.
Pour finir, notons que cette introduction à suivi une approche dite phénoménologique de la thermodynamique. Cette approche décrit les phénomènes à l’œuvre par une description macroscopique basée sur les observations. Elle est complémentaire à une approche plus calculatoire et basée sur l’étude des propriétés microscopiques connue sous le nom de physique statistique. Le lecteur intéressé à poursuivre son étude de la thermodynamique pourra s’intéresser aux principes de cette seconde approche, ou bien poursuivre sur la voie phénoménologique en étudiant les deux grands principes régissant la conservation de l’énergie et le sens des échanges thermiques.
 Concepts généraux de la thermique
Concepts généraux de la thermique