Le corps humain est en permanence exposé à des agents externes. Certains sont pathogènes, mais d’autres non, voire bénéfiques pour le corps. On peut citer la flore intestinale également appelée microbiote intestinal. Le rôle du système immunitaire est de maintenir l’intégrité de l’organisme face à ces agresseurs externes en freinant leur propagation et en éliminant ceux qui sont entrés. Pour comprendre le système immunitaire, les immunologistes ont développé le concept du soi et du non-soi, qui s’appuie sur des considérations assez simples. Le soi correspond à l’ensemble de ce qui appartient à l’organisme et contre lequel il ne doit en aucun cas être dirigé ; le non-soi correspond à tout le reste. Parmi le non-soi, comme certains micro-organismes sont bénéfiques pour le corps ou que certaines molécules ne sont pas dangereuses comme le pollen, l’organisme doit être en mesure de distinguer le non-soi pathogène du non-soi qu’il doit tolérer.
Si on récapitule, l’organisme doit donc être capable :
- de distinguer le soi du non-soi et du soi modifié (tumeur par exemple)
- de tolérer certains agents du non-soi
- de répondre à la présence d’agents pathogènes pour les éliminer
On voit donc qu’il y a là un équilibre du système immunitaire : une balance entre une tolérance et une rigueur immunitaire qui est nécessaire à l’intégrité de l’organisme. Une tolérance trop faible peut entraîner des maladies auto-immunes tandis qu’un défaut de rigueur peut profiter à certains agresseurs ou à des cellules tumorales.
Mais avant même de pouvoir parler de tolérance du système immunitaire et d’équilibre de la réponse immunitaire, il faudrait savoir comment l’organisme distingue le soi et le non-soi. Ainsi au cours de ce petit article qui va suivre, je vous propose de découvrir les grands principes de la reconnaissance du soi et du non-soi. Nous allons voir ensemble les éléments les mieux décrits à ce jour concernant la reconnaissance des agents étrangers.
L’immunologie est une science à la fois très complexe et très dense. C’est une science qui bouge beaucoup avec régulièrement de nouvelles découvertes mettant en évidence de nouveaux mécanismes de détection, de tolérance ou de réponse immunitaire. Le texte qui suit ne traite qu’un des aspects de la détection ; je vous propose de parler de ce qui fait aujourd’hui consensus et qui reste néanmoins suffisant pour aborder ce point du système immunitaire.
- Présentation rapide du système immunitaire
- Reconnaissance de motifs antigéniques
- Génération d'un répertoire de récepteurs à des antigènes
- Apprêtement des antigènes sur des complexes de présentation
- Activation des lymphocytes
Présentation rapide du système immunitaire
On l’a évoqué, le système immunitaire doit garantir le maintien de l’intégrité du corps face aux agents pathogènes externes, mais également au soi modifié (cancer) tout en étant tolérant au soi et au non-soi qui n’est pas pathogène.
Présentation du système immunitaire inné et adaptatif
On sépare globalement le système immunitaire en 2 parties (qui ne sont pas séparées mais se complètent) :
- le système immunitaire inné. Il représente la première ligne de défense et reconnaît certains motifs associés aux pathogènes, en anglais Pathogen-Associated Molecular Patterns qu’on abrégera alors PAMP. Les cellules du système immunitaire inné sont rapidement recrutées mais ne présenteront pas de mémoire immunitaire.
- le système immunitaire adaptatif. Il est plus long à être recruté mais vise des cibles plus spécifiques ; chaque cellule effectrice ne reconnaîtra qu’un fragment de pathogène. Il complète ainsi la réponse immunitaire. Il reconnaît ainsi par exemple des protéines, des lipides ou des sucres qui n’appartiennent pas au soi.
La reconnaissance des PAMP par les cellules garantit au système inné de reconnaître à peu près l’ensemble des pathogènes. Ces motifs moléculaires associés aux pathogènes sont des cibles de choix car la plupart des pathogènes ont besoin de ces éléments pour leur propre survie et pathogénicité. Le système immunitaire adaptatif repose sur des cellules ne reconnaissant qu’un fragment de pathogène donc à spectre d’action beaucoup plus restreint, mais très efficace qui complète le spectre de reconnaissance du système adaptatif inné.
Toute molécule capable d’induire une réponse immunitaire est appelée antigène. L’antigène peut être de natures variées mais dans la suite du texte, on parlera surtout des antigènes de nature protéique. Un tel antigène peut voir diriger spécifiquement contre lui les armes du système immunitaire, des réponses du système inné et/ou adaptatif. Parlons donc de ces armes.
Le système immunitaire, inné comme adaptatif, repose sur des cellules et des molécules solubles. Les cellules peuvent être effectrices ou à fonction de communication :
-
Les cellules effectrices peuvent sécréter des éléments directement actifs contre le pathogène (comme les anticorps par exemple).
-
Les cellules à fonction de communication sécrètent des molécules solubles détectées par d’autres et qui renseignent alors les cellules avoisinantes. Il existe plusieurs types de molécules de signalisation et les nombreuses découvertes successives de telles molécules ont abouti à différentes nomenclatures pour les classer. On essaie maintenant de développer la nomenclature des cytokines qui change leurs noms pour adopter un système unique d’appellations. Elles peuvent avoir plusieurs fonctions, comme déclencher une réaction inflammatoire à l’endroit de l’infection, recruter et guider des cellules effectrices ou participer à la maturation d’autres cellules du système immunitaire.
Voici un tableau reprenant ces différentes catégories et donnant des exemples de cellules et molécules impliquées :
|
Système |
Effecteurs cellulaires |
Effecteurs solubles |
|---|---|---|
|
Inné |
Polynucléaires, Macrophages résidents |
Cytokines |
|
Adaptatif |
Lymphocytes, cellules dendritiques |
Anticorps |
Regardons maintenant chaque partie du système immunitaire de plus près.
Les cellules du système immunitaire inné
Les polynucléaires et les lymphocytes sont des cellules du sang (à une concentration cellulaire totale d’environ 5000 cellules par µL). On les appelle les globules blancs (ou leucocytes, ce qui veut dire la même chose en grec). Les polynucléaires sont capables de sortir des vaisseaux sanguins dans les tissus enflammés (processus de diapédèse ou d’extravasation).
Nous rediscuterons du processus d’inflammation un peu plus loin. On se contentera de dire pour le moment que c’est une réaction de l’organisme face à un pathogène qui autorise la sortie du sang des globules blancs au niveau des tissus infectés. Tous les polynucléaires peuvent sortir mais parmi les lymphocytes, seuls les lymphocytes activés peuvent sortir des vaisseaux. Nous reviendrons sur cette notion d’activation des lymphocytes.
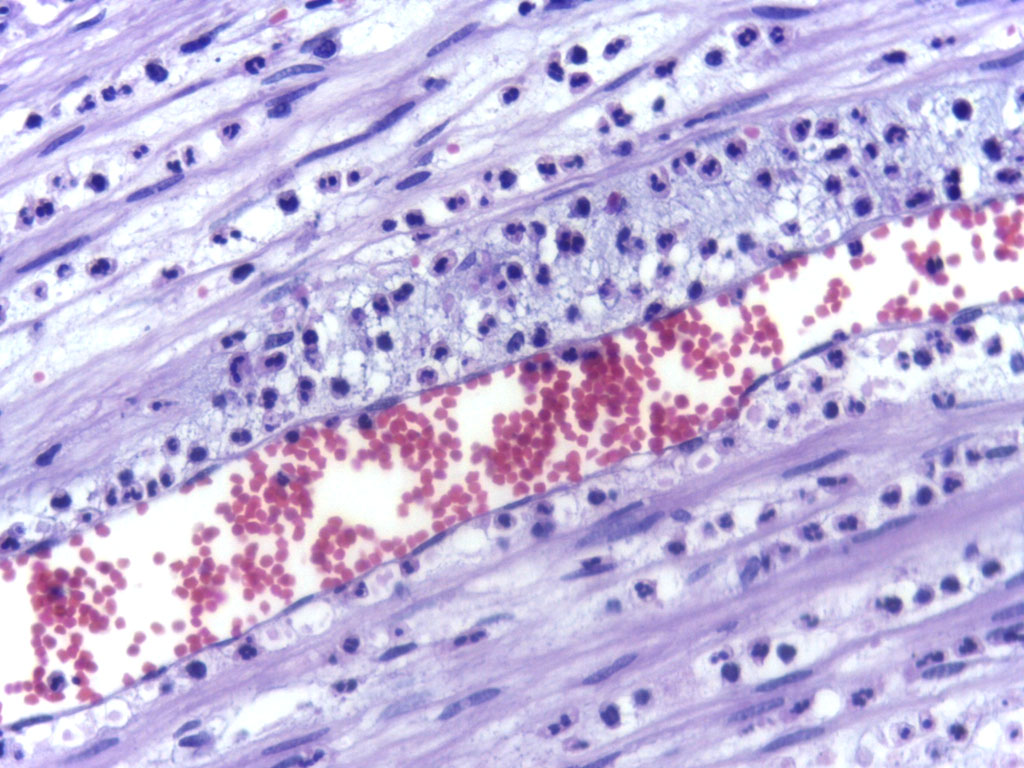
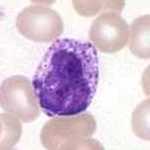
Les polynucléaires sont des cellules effectrices du système immunitaire inné. Ils sont ensuite séparés en 3 populations, les neutrophiles, les basophiles et les éosinophiles (les noms proviennent de leurs réactions à ces colorants neutres, basiques ou à l’éosine), chacune ayant son propre rôle. On dira que principalement les neutrophiles sont capables de phagocytose, les éosinophiles interviennent dans des réactions contre des parasites et les basophiles, chez un individu occidental, sont surtout étudiés pour leur rôle dans l’allergie.
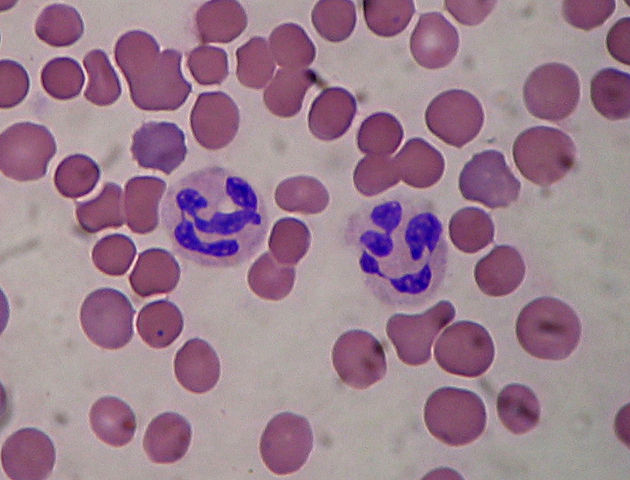
Dans les tissus résident également des cellules telles que des macrophages ou des cellules dendritiques. Les macrophages participent à la dégradation des pathogènes par le processus de phagocytose. Ils représentent donc les premières cellules à capacité de phagocytose pour lutter contre les pathogènes, avant l’arrivée de neutrophiles pour les aider à dégrader les agents étrangers qui ne quitteront la circulation qu’en cas d’infection avérée.
Les cellules dendritiques sont elles-aussi séparées en plusieurs sous-populations qui ont chacune leur rôle. Elles peuvent détecter des pathogènes et sécréter des cytokines pro-inflammatoires ou des molécules de signalisation. Ces molécules maintiennent, en cas d’infection, les cellules des alentours dans un état réfractaire à la réplication de virus et participent à l’activation des lymphocytes du système adaptatif comme les interférons. Elles peuvent également activer d’autres cellules du système immunitaire adaptatif, les lymphocytes.
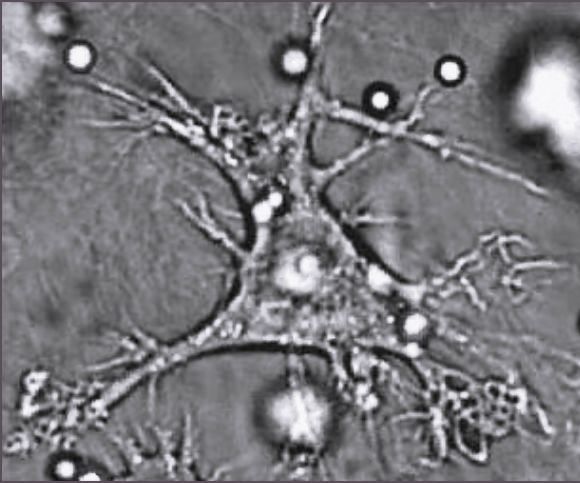
Les cellules dendritiques qui ont un tel rôle d’activation des lymphocytes sont appelées les cellules dendritiques conventionnelles (abrégées cDC dans la littérature pour « conventional dendritic cells »). Ce sont surtout d’elles dont on parlera dans la suite.
Les cellules du système immunitaire adaptatif
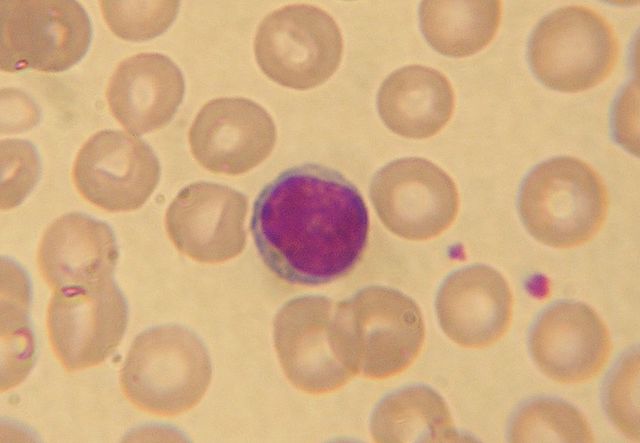
Les lymphocytes sont donc les armes du système immunitaire adaptatifs. Ils sont séparées en plusieurs populations dont 2 principales : les B, producteurs d’anticorps, et les T, eux-mêmes séparés en sous-populations principales, les T CD8 et les T CD4. Ils se distinguent les uns des autres par le type de récepteurs qu’ils expriment et, naturellement, cela a une conséquence sur leurs rôles respectifs.
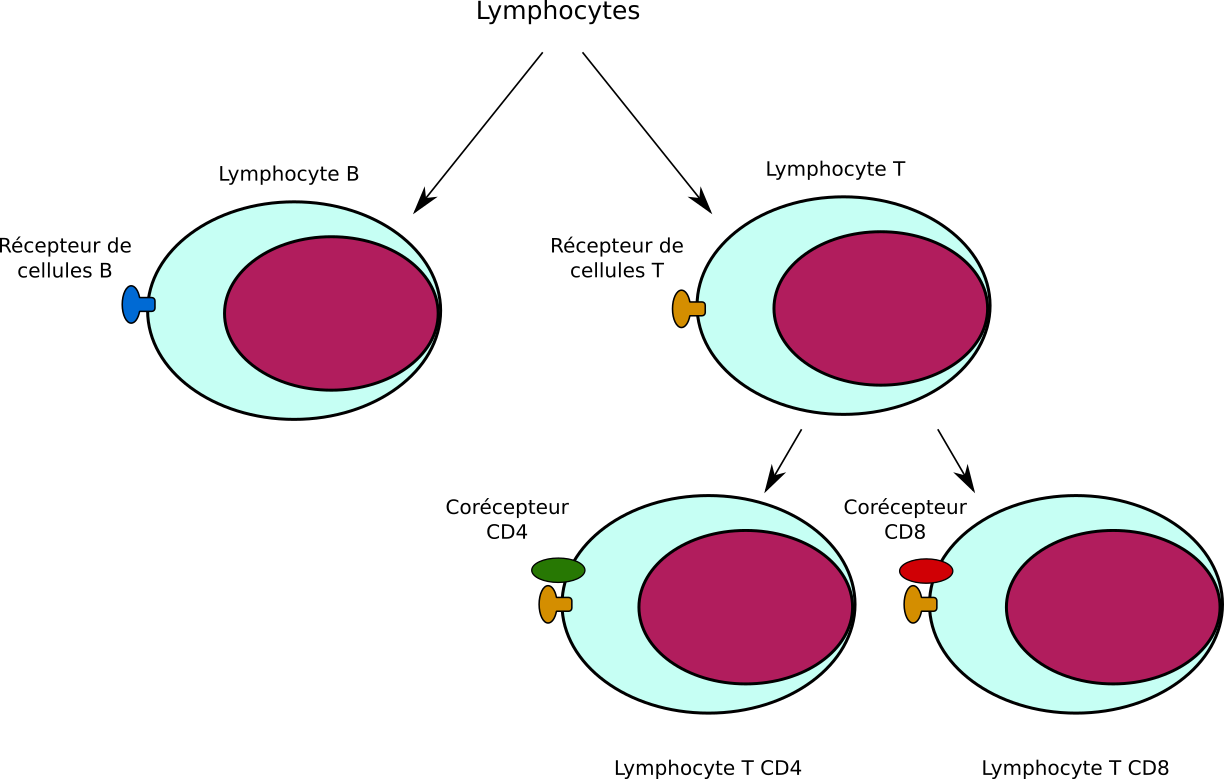
Le sigle CD signifie « cluster of differentiation », soit en français « marqueur de l’état de différenciation ». En effet, comme on l’a dit, l’immunologie est une science complexe et les populations cellulaires peuvent se différencier en des sous-populations à allure similaire mais néanmoins distinctes, avec leurs propres rôles. Au cours de cette différenciation, les cellules vont exprimer de nouvelles protéines ou cesser d’en exprimer d’autres : ces protéines servent donc à différencier les cellules les unes des autres. Elles sont donc nommées CD $n$, avec $n$ le nombre qui sert à identifier de quelles protéines on parle. On notera qu’ici, on se fiche de la fonction réelle des protéines CD $n$, on veut juste s’en servir pour identifier la sous-population cellulaire à laquelle on a affaire.
Une cellule qui exprime le marquer CD $n$ est dite CD $n$ + (ou CD $n$ tout court, comme par exemple T CD4 et T CD8) et réciproquement, si elle ne le fait pas, elle est dite CD $n$ -. Parfois, la distinction ne se fait pas si simplement par la règle +/- selon si présent ou absent, mais par le niveau de présence (faible ou fort). Comme souvent, les notations anglaises prennent le dessus dans la littérature et on parlera de CD $n$ low ou high pour faible ou fort.
Les lymphocytes B sécrètent les anticorps de l’organisme. Les T CD8 ont une fonction cytotoxique (ils induisent la mort des cellules infectées, par un virus ou une bactérie intracellulaire par exemple). Les T CD4 interviennent dans la communication entre cellules immunitaires et vont participer à la maturation des lymphocytes B et des T CD8.
Une abréviation courante des lymphocytes B est LB et naturellement pour les lymphocytes T, LT. Les T CD8 sont appelés T cytotoxiques (en lien avec leur fonction) et notés Tc ; les T CD4 ont un rôle d’auxiliaire et sont donc appelés T auxiliaires ou T helpers, notés parfois TH.
Notion de différenciation des cellules
Ceux qui ont déjà touché à de la biologie cellulaire savent de quoi il va être question. Mais il est nécessaire d’en parler car cette notion est capitale dans le fonctionnement du système immunitaire. Les cellules ont la capacité de se différencier, c’est-à-dire une capacité à réaliser de nouvelles fonctions par rapport à son état précédent. Ce processus s’accompagne d’un changement dans l’expression de gènes (on rejoint la notion de « clusters of differenciation » évoquée plus haut) et de morphologie, qui sous-tendent la fonction cellulaire nouvelle (ou la perte d’une fonction).
Prenons un exemple, la différenciation des cellules sanguines depuis les précurseurs hématopoïétiques :
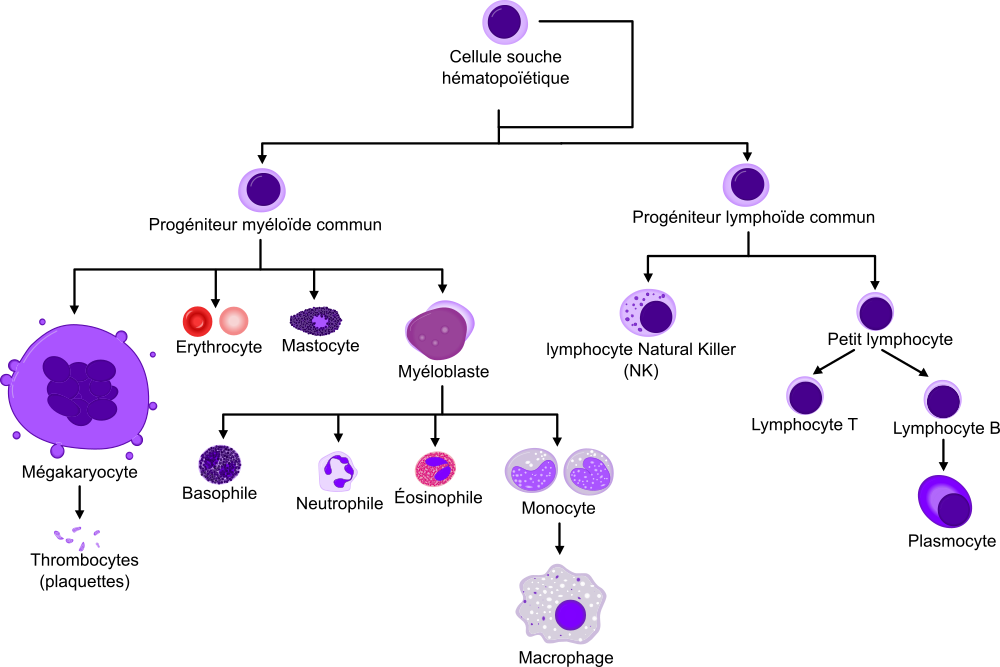
La différenciation de cellules permet de générer plusieurs types cellulaires depuis un progéniteur commun. Mais elle sert également à transformer des cellules immatures en cellules matures. On évoquera un peu plus loin par exemple que la formation de cellule T mature nécessite le passage par plusieurs stades où e lymphocyte change de comportement avant de devenir le lymphocyte T naïf capable de rencontrer son antigène.
Fonctionnement global du système immunitaire
Activation de l’immunité innée
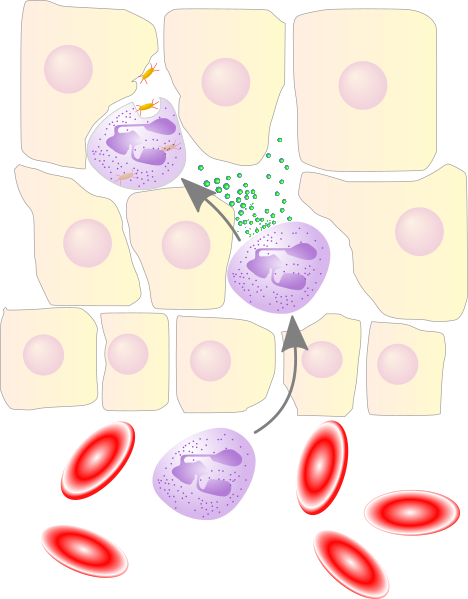
Les cellules de l’immunité innée restent dans le sang en absence d’infection. En revanche, en cas de détection de pathogènes, des cellules des tissus vont sécréter des cytokines inflammatoires telles que l’interleukine 1 (IL-1) ou le TNF-α (Tumor Necrosis Factor), qui vont agir sur les vaisseaux sanguins locaux et augmenter ici l’influx sanguin. Les tissus vont gonfler légèrement, l’apport de sang va augmenter légèrement la température et donner une couleur rougeâtre aux tissus, ce qui forment les symptômes observables de l’inflammation. Ainsi, plus de cellules immunitaires peuvent être drainées au niveau du foyer infectieux et les vaisseaux deviennent permissifs à l’extravasation des cellules immunitaires. Les signaux inflammatoires potentialisent également les récepteurs de la douleur au niveau de l’inflammation, ce qui accroît la sensibilité des tissus aux moindres stimuli qui apparaissent alors comme douloureux.
Activation de l’immunité adaptative
On l’a évoqué, les lymphocytes sont spécifiques d’un antigène donné. Il faut donc s’assurer que les lymphocytes puissent rencontrer leur antigène. Pour cela, le système immunitaire s’appuie sur des cellules résidant dans les tissus et sur la circulation des lymphocytes.
Comme cellules résidentes, on l’a vu, on trouvera des macrophages et des cellules dendritiques qui réagissent aux PAMP. On a également mentionné que les lymphocytes et les polynucléaires circulent en permanence. Mais pour comprendre la suite, on va devoir se pencher un peu sur la circulation lymphatique.
La circulation sanguine est quelque chose de connue, le sang part du cœur gauche et revient au droit, puis passe par les poumons et ainsi de suite. La circulation lymphatique est cependant peut-être moins bien connue, or on va le voir, les lymphocytes passent également par la lymphe (qui leur donnent son nom).
La lymphe est un fluide qui circule depuis les tissus périphériques où elle est formée par ultrafiltration du sang
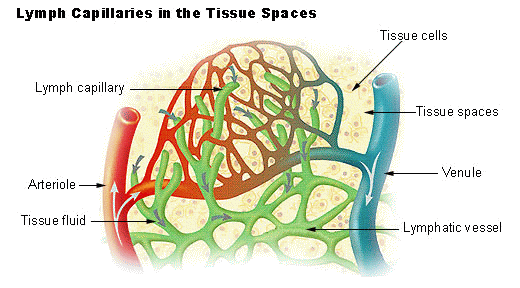
Le plasma ultrafiltré passe dans les tissus et constitue ainsi le liquide interstitiel dans lequel baignent les cellules. Or, si le débit d’ultrafiltration est faible, il est néanmoins réel et donc le liquide interstitiel s’accumulerait. Ce n’est pas le cas grâce à la circulation lymphatique, qui draine ce liquide interstitiel et l’achemine ensuite à la circulation sanguine. Or, sur le chemin qui amène au sang depuis les tissus, la lymphe va passer par des structures particulières, les ganglions lymphatiques.
Quand la lymphe se forme depuis les tissus, elle ne contient pas encore les lymphocytes. En revanche, en drainant ainsi le liquide interstitiel dans lequel baignent les cellules du corps, la lymphe peut ainsi drainer tout antigène qui se serait retrouvé dans les tissus, ou bien encore entraîner toute cellule dendritique qui aurait rencontré un pathogène et qui serait donc activée, capable de présenter cet antigène à un lymphocyte.
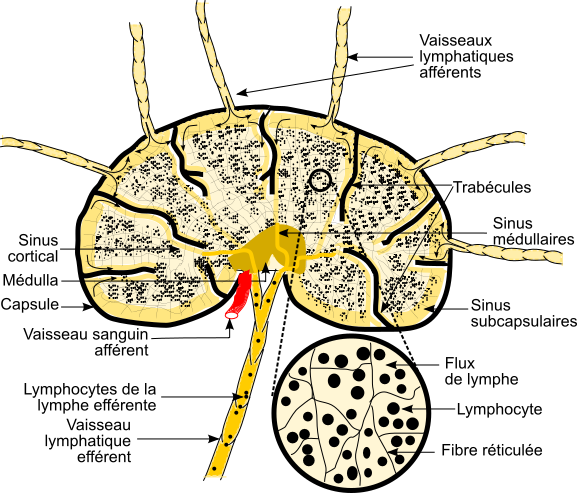
Le ganglion lymphatique est donc une structure-clef de la rencontre entre les antigènes et les lymphocytes. Les ganglions sont tous irrigués par le sang et les vaisseaux des ganglions forment des structures particulières dites à endothélium élevé. Ces structures sont permissives aux lymphocytes naïfs pour leur sortie par diapédèse. Ainsi, contrairement aux autres vaisseaux où seuls les lymphocytes activés par leur rencontre avec leur antigène peuvent sortir (et uniquement en cas d’inflammation), au niveau des veinules à endothélium élevé, les lymphocytes naïfs peuvent sortir du sang. Les lymphocytes peuvent donc entrer en contact avec leur antigène si celui-ci a été drainé par la lymphe.
Les lymphocytes qui ne rencontrent pas leur antigène restent naïfs et quittent le ganglion en passant par la lymphe. Ils rejoindront le sang ensuite. Si ils ont rencontré dans cette structure leur antigène contre lequel ils sont dirigés, ils sont activés et vont entrer dans une phase de prolifération et de différenciation, passant du stade naïf au stade de cellule effectrice ou de cellule mémoire. Le ganglion va donc grossir.
Les lymphocytes ainsi activés vont donner naissances à des populations de cellules effectrices et cellules mémoires :
- Les lymphocytes B effecteurs deviennent ce qu’on appelle des plasmocytes qui produisent des anticorps contre l’antigène qu’ils ont reconnus. Les T CD8 effecteurs vont induire la mort des cellules qui portent les antigènes contre lesquels il est dirigé (typiquement, des cellules infectées par un virus ou une bactérie intracellulaire) ; les T CD4 deviennent ce qu’on appelle des lymphocytes auxiliaires qui fournissent des signaux aux autres cellules du système immunitaire.
- Les populations mémoires sont à plus longue durée de vie et s’auto-entretiennent sur le long-terme et continuent de former les lymphocytes correspondant, permettant de maintenir les populations de cellules effectrices et capables de s’activer à nouveau rapidement pour produire à nouveau de grandes quantités de cellules effectrices.
Reconnaissance de motifs antigéniques
Dans cette partie, on va parler de la reconnaissance des PAMP. La notion de PAMP a été proposée pour expliquer la capacité du système immunitaire inné à réagir face à des motifs moléculaires génériques, portés par les pathogènes exclusivement et donc pas par les cellules humaines. Les récepteurs aux PAMP sont appelés les récepteurs de reconnaissance des motifs ou Pattern Recognition Receptors (PRR). La plupart des cellules, aussi bien du système immunitaire que les autres, portent de tels récepteurs.
Parmi les récepteurs les mieux connus de cette famille, on peut citer les récepteurs de type Toll (Toll-like Receptors ou TLR). Il en existe plusieurs types, nommés TLR1, TLR2 etc… Chaque type va reconnaître un motif particulier, par exemple le TLR4 qui va reconnaître le lipopolysaccharide (LPS) des bactéries, le TLR2 leur peptidoglycane, qui sont tous deux constitutifs des enveloppes bactériennes ; on peut également citer le TLR3 qui va reconnaître des acides nucléiques de virus.
Une fois qu’un récepteur a reconnu et lié sa cible, il va entraîner une réponse cellulaire par l’activation de voies de signalisation, qui vont permettre :
- la production de molécules de signalisation (des cytokines donc) permettant l’alerte des cellules avoisinantes ;
- l’activation de la réponse inflammatoire (qu’on a décrite précédemment) ; ou
- le guidage d’autres cellules vers les lieux de l’inflammation.
Des cellules spécialisées dans l’immunité peuvent également être activées par ces PAMP et déclencher leur réponse, telles que la phagocytose par les macrophages par exemple.
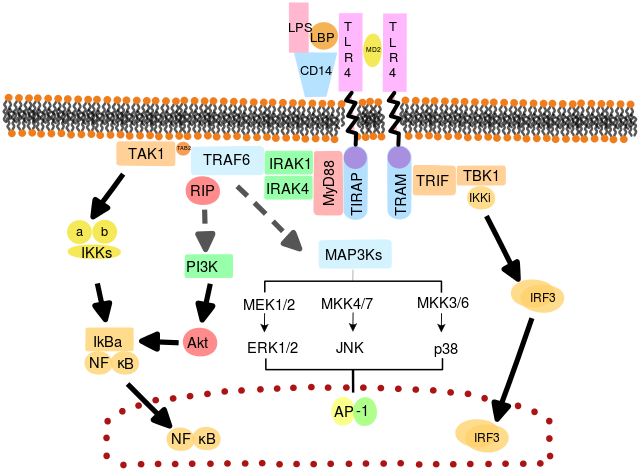
C’est ainsi que des cellules du système immunitaire inné peuvent faire la distinction entre cellules du soi et du non-soi : elles reconnaissent via leurs PRR des motifs moléculaires de pathogènes et traquent ces pathogènes.
Par ailleurs, les PAMP et les PRR sont également à l’origine de l’activation de la réponse immunitaire adaptative au moyen de l’activation des cellules dendritiques. Une cellule dendritique peut être exposée à de nombreux antigènes sans forcément y réagir. On peut décrire cela comme étant un mécanisme de sécurité quant à la tolérance immunitaire : des antigènes qui ne sont pas associés à des pathogènes (comme le pollen des arbres par exemple) ne déclenchent pas d’activation de l’immunité. Les cellules dendritiques capturent des antigènes auxquels elles sont exposées dans les tissus périphériques mais sans forcément être activées pour autant et donc sans les présenter aux lymphocytes.
En revanche, une cellule dendritique conventionnelle (cDC) activée par un PAMP est alors autorisée à migrer vers les ganglions lymphatiques pour y présenter les antigènes qu’elle a capturés (qui est donc a priori un antigène de pathogène). Cette activation des cDC est à la base de l’activation de la réponse adaptative.

Génération d'un répertoire de récepteurs à des antigènes
L’immunité innée, on l’a vu, repose sur un faible nombre de récepteurs de pathogènes qui lui suffise. En revanche, l’immunité adaptative passe par des cellules spécifiques d’un (ou quelques) antigène. Elles ont donc un spectre de reconnaissance beaucoup plus étroit, qui est compensé par généralement une très bonne affinité pour leur cible et donc une bonne efficacité.
Ainsi, l’immunité adaptative nécessite la présence d’un répertoire très grand de lymphocytes, de sorte qu’il existe dans le corps au moins quelques lymphocytes parmi tous qui puissent réagir face à un pathogène donné. Cela implique donc que chaque lymphocyte possède son propre récepteur. Or, cela pose un problème : les récepteurs sont codés par le génome humain, qui est évidement de taille finie et, qui plus est, ne sert pas qu’à coder les protéine liées à l’immunité, mais bien l’ensemble des protéines du corps. La taille limitée du génome humain ne peut donc pas permettre de coder directement le nombre infiniment grand de récepteurs TCR et BCR.
La génération des récepteurs de lymphocytes va reposer sur une partie seulement du génome mais qui présente une très grande capacité de combinatoire. Chaque lymphocyte va ainsi générer au hasard son propre récepteur, de sorte qu’avec une taille finie on puisse générer l’ensemble du répertoire de lymphocytes existants. Ce mécanisme est appelé la recombinaison VDJ.
Structure des récepteurs à créer : BCR et TCR
Nous avions parlé de deux grandes populations de lymphocytes : les B et les T (eux-mêmes divisés entre les T CD4 et les T CD8). Les B vont présenter un récepteur appelé BCR (B-cells Receptors) et les T un TCR (T-cells Receptors, sans grande surprise). Ces deux types de récepteurs ont chacun leur propre architecture générale :
- Les BCR sont une forme membranaire d’anticorps constitués de 2 chaînes lourdes identiques (H pour heavy en anglais) et de 2 chaînes légères identiques (L pour light, légères).
- Les TCR sont constitués de 2 chaînes α et β.
Les BCR correspondent en réalité à l’anticorps que produira le lymphocyte B une fois activé, rendu membranaire par mécanisme d’épissage alternatif
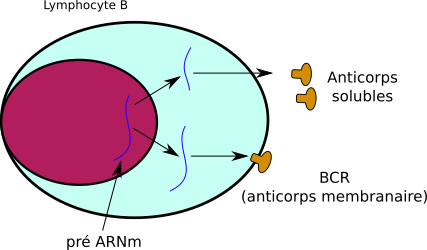
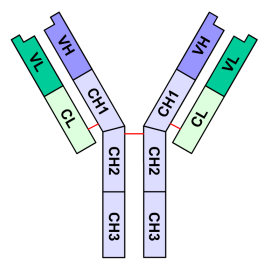
Un BCR est capable de reconnaître directement son antigène dans le milieu. Un TCR ne peut reconaître le sien directement en solution mais nécessite une présentation particulière de l’antigène par les cellules, ce dont on rediscutera dans la partie suivante.
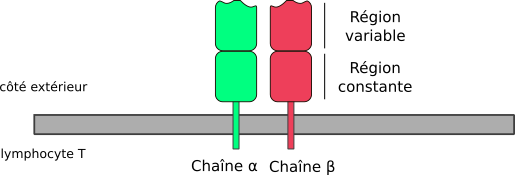
Que ce soit pour le BCR ou le TCR, il va donc falloir générer des chaînes aléatoirement depuis le génome. Toute la chaîne n’est pas aléatoirement générée, une partie reste constante. La partie constante permet la cascade d’activation une fois que la partie variable du récepteur a fixé sa cible.
Les précurseurs de lymphocytes, B comme T, sont produits par la moelle osseuse. Ils dérivent de cellules souches hématopoïétiques qui produisent l’intégralité des cellules sanguines, dont les cellules de l’immunité. À ce stade, les précurseurs n’ont pas encore tenté la recombinaison VDJ. La génération aléatoire de la partie variable a lieu lors de la maturation des lymphocytes ; les B sont maturées dans la moelle osseuse et les T dans le thymus, une glande située un peu au-dessus du cœur.
Nous allons parler de la maturation des lymphocytes B dans un premier temps. Il faut générer une chaîne lourde et une légère. Les deux chaînes sont portées par deux chromosomes différents.
La chaîne lourde va nécessiter l’assemblage au hasard de 3 segments, chacune des 3 étant choisie au hasard parmi un répertoire de séquence existant sur son chromosome. Ces 3 segments à choisir sont nommés V, D et J pour variabilité, diversité et jonction (jonction avec la partie constante).
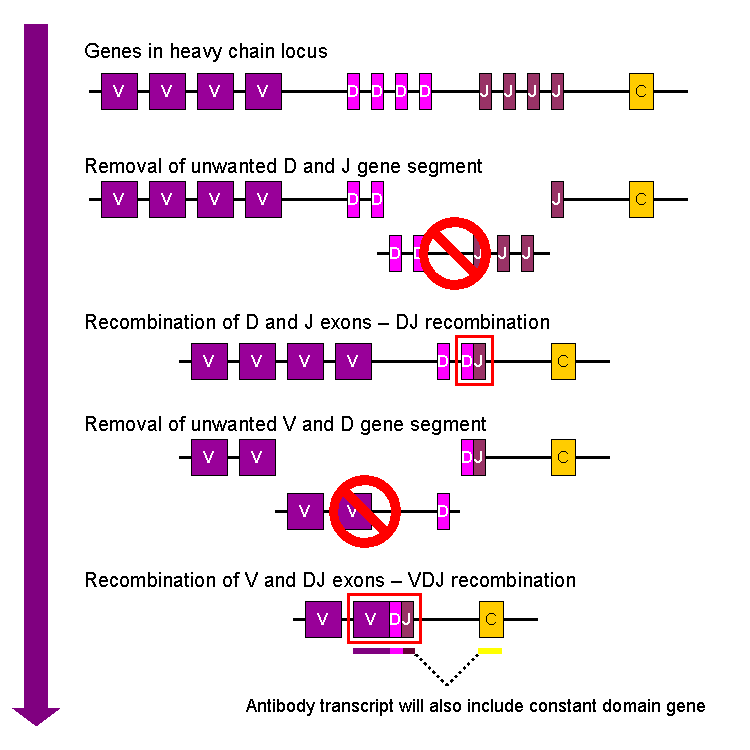
Ainsi, les séquences entre les segments retenus sont éliminées du chromosome. À la fin, il ne reste plus que la partie variable VDJ reliée à la partie constante, ce qui forme la chaîne lourde.
La diversité résulte de la combinatoire à laquelle s’ajoute d’autres phénomènes lors de la jonction qui, toujours au hasard, vont rajouter une diversité appelée diversité jonctionnelle.
Il faut ensuite créer une chaîne légère L. La chaîne légère quant à elle ne va comporter que 2 segments choisis aléatoirement V et J. À nouveau, on dispose d’une assez bonne combinatoire pour la seule génération de la chaîne légère.
Le BCR est formé de l’assemblage des chaînes lourdes et légères, ce qui signifie que la diversité de BCR possible repose sur la diversité de combiner une chaîne lourde à une chaîne légère. À la fin, on estime que la capacité de combinatoire est supérieure à 1011 1.
Naturellement, parmi tous ces phénomènes aléatoires, il y a d’abord un risque d’obtenir une structure instable qui ne puisse être synthétisée correctement. Dans ce cas, le lymphocyte n’a pas de BCR à sa surface et son absence déclenche un signal de mort au lymphocyte. Il ne subsistera que les lymphocytes codant un BCR fonctionnel.
D’autre part, certains lymphocytes B vont alors présenter un BCR réagissant non pas contre un pathogène mais contre le soi. Les lymphocytes B en cours de maturation dans la moelle osseuse qui réagirait contre des antigènes du soi seront éliminés de la même façon que précédemment, par mort du lymphocyte autoréactif. Par ailleurs, l’activation des B nécessite des signaux en provenance des lymphocytes T, dont la sélection est beaucoup plus stricte que celle des B.
Les lymphocytes T, de la même façon, vont générer leurs chaînes α et β par recombinaison également appelée recombinaison VDJ (mais qui porte sur d’autres segments naturellement). De la même façon, la combinatoire des deux chaînes, des segments et la diversité jonctionnelle aboutit à un grand panel de lymphocyte T, d’environ 1016 1.
Pour pouvoir discuter de la sélection des lymphocytes T, il faut avant tout parler de la présentation des antigènes aux lymphocytes T car, comme on l’a dit, les lymphocytes T ne sont pas capables de reconnaître directement leur antigène mais nécessitent leurs apprêtement par les cellules de l’organisme
Apprêtement des antigènes sur des complexes de présentation
Le corps humain est capable de distinguer les cellules du soi et du non-soi grâce à des complexes membranaires, présents donc à la surface des cellules de l’organisme. Ces complexes membranaires sont appelés CMH (Complexes Majeurs d’Histocompatibilité), qui sont découpés en 2 catégories : le CMH de classe I et le CMH de classe II.
Hormis les globules rouges et cellules reproductrices et hors cas pathologiques, toutes les cellules expriment le CMH-I. Seules certaines cellules expriment le CMH-II : elles sont appelées les cellules présentatrices d’antigènes. Parmi elles, on mentionnera surtout les cellules dendritiques, les macrophages et les lymphocytes B.
Les CMH comptent parmi les gènes pour lesquels la diversité génétique à l’échelle de la population humaine est la plus grande. En effet, comme on va le voir, les CMH sont impliqués dans la présentation des antigènes donc certains CMH présentent des avantages pour la présentation de certains peptides et pas pour d’autres et ainsi de suite. En conséquence, une grande variabilité pour ces gènes a été favorisée, de sorte qu’il est très difficile de trouver deux personnes avec un CMH identique.
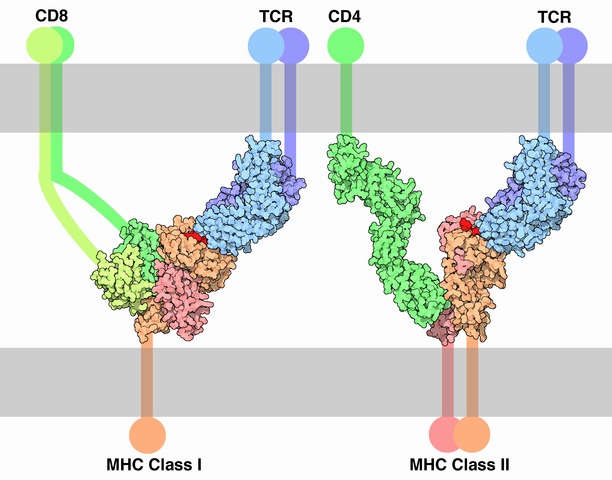
Les lymphocytes ne peuvent reconnaître que les peptides présentés sur une molécule de CMH. Cette propriété s’appelle la restriction au CMH. Par ailleurs, les lymphocytes T CD8 ne reconnaissent que les peptides présentés sur CMH-I et les T CD4 que ceux sur CMH-II. En effet, les molécules CD4 et CD8 sont des corécepteurs et chacun reconnaît une des deux classes de CMH seulement.
CMH de classe I
Le CMH de classe I a la structure suivante :

Comme on peut le voir, on le découpe en 4 domaines répartis sur 2 chaînes α et β (attention : ne pas confondre avec les chaînes du TCR, la notation α et β sert, au sein d’un complexe, à décrire de quelle chaîne on parle). La chaîne α est plus grande que la β.
Entre les domaines α1 et α2 se trouve une poche dans laquelle vient se glisser un peptide. La présence de ce peptide est obligatoire pour maintenir la stabilité du CMH-I. Ainsi, la cellule expose en permanence des peptides, ou plus exactement des complexes CMH-I - peptides. Par souci de simplicité d’écriture on parlera de présentation de peptides, mais il ne faut pas perdre de vue que les lymphocytes reconnaissent l’ensemble du CMH-I et du peptide qu’il présente.
Les peptides ont pour origine des fragments de protéines intracellulaires, qui sont partiellement dégradées par la cellule en plus courts fragments peptidiques et ces peptides sont chargés ensuite sur des molécules de CMH-I. Le CMH-I présente donc des peptides d’origine intracellulaire. On peut alors comprendre l’intérêt de la présence du CMH-I sur la quasi-totalité des cellules : une cellule saine exposera des peptides du soi seulement, une cellule infectée par un agent intracellulaire (virus, bactéries intracellulaires) présentera sur son CMH-I des peptides du non-soi.
Cette présentation de peptides sert alors de signal aux lymphocytes T cytotoxiques, une fois qu’ils ont été activés, pour repérer les cellules infectées par un tel agent pathogène. Les T cytotoxiques qui reconnaîtraient alors un CMH-peptide induiront la mort de la cellule infectée — un mal pour un bien, en somme.
On peut alors comprendre un peu l’intérêt de certains CMH pour la présentation de certains peptides plutôt que d’autres : puisque c’est le complexe peptide-CMH qui est reconnu, certains CMH fournissent un environnement plus favorable pour une reconnaissance efficace par les lymphocytes que d’autres.
CMH de classe II
Contrairement au CMH-I, seules quelques cellules vont présenter un CMH de classe II, les cellules présentatrices d’antigène (CPA). Pour rappel, voici les principales CPA dont on parlera : les cellules dendritiques, les lymphocytes B et les macrophages.
De la même façon, le CMH-II va permettre la présentation de peptides mais différemment. Voici la structure du CMH-II :

Le CMH-II à nouveau nécessite la présence d’un peptide dans un sillon pour être stable. En revanche, la provenance du peptide est différente. Les cellules présentatrices d’antigène récupèrent des antigènes en provenance du milieu extérieur ; ces antigènes vont être dégradés eux aussi en peptides (par une voie différente de celle des protéines intracellulaires, ce qui fait qu’ils ne se mélangent pas) et finiront sur une molécule de CMH-II.
Les CPA présentent donc des antigènes du milieu extérieur qu’elles auraient récupérés. Les cellules dendritiques par exemple, après activation par un PAMP, pourront exposer l’antigène capturé au niveau des ganglions lymphatiques aux lymphocytes T CD4.
Un T CD4 qui est dirigé contre l’antigène reconnaît donc le peptide présenté par la cellule dendritique et est ensuite activé ; il va pouvoir ensuite sécréter des cytokines destinées à d’autres cellules du système immunitaire et coordonner les réponses immunitaires.
Le CMH-II permet alors une présentation privée de peptides entre cellules du système immunitaire : un T CD4 activé par une cellule dendritique peut ensuite donner des signaux guidant la réponse immunitaire, en donnant des signalisations ou autres stimulations à d’autres cellules présentatrices d’antigène telles que les LB et les macrophages qui présenteraient le même antigène.
Conclusion sur les CMH
Les CMH de classe I et II permettent une présentation de peptides apprêtés par les cellules. Les peptides ainsi apprêtés peuvent permettre, dans un premier temps, l’activation de lymphocytes T (CD8 pour CMH-I, CD4 pour CMH-II) dirigés contre eux, dans un deuxième temps de servir aux lymphocytes pour reconnaître leurs cibles. Les T cytotoxiques reconnaissent les cellules infectées et en induisent la mort cellulaire ; les T CD4 agissent comme auxiliaires auprès d’autres cellules qui présenteraient les peptides contre lesquels ils sont dirigés et leur donnent des signaux via des cytokines.
Sélection des lymphocytes T par le thymus
On avait évoqué rapidement la sélection des lymphocytes B et l’élimination des lymphocytes autoréactifs. Mais on n’avait pas vu celle des T car nous avions besoin de savoir comment un lymphocyte reconnaît sa cible. Avec la connaissance du CMH et de la présentation des peptides, nous sommes fin prêts. Les précurseurs de lymphocytes T sont produits par la moelle osseuse mais finissent leur maturation dans le thymus, d’où leur nom de lymphocytes T, alors que les B s’appellent ainsi car ils ont été découverts chez les oiseaux au niveau d’un organe appelé la Bourse de Fabricius.
Par ailleurs, on notera également que leur nom de lymphocyte B est un moyen mnémotechnique de se souvenir qu’ils finissent leur maturation dans la moelle osseuse, bone marrow en anglais.
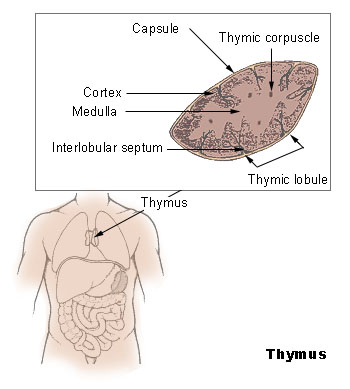
Un lymphocyte T qui arrive au thymus y crée son propre TCR par la recombinaison VDJ. Naturellement, les lymphocytes à TCR non fonctionnel sont éliminés. Les lymphocytes, une fois leur TCR créé, évoluent pour devenir soit des T CD4 et reconnaître le CMH-II, soit des T CD8 et reconnaître le CMH-I. Il reste donc à comprendre la sélection des lymphocytes viables pour éviter les autoréactifs. La sélection des lymphocytes est canoniquement séparée en 2 temps : la sélection positive et la sélection négative.
Le thymus se divise en deux parties : la partie plus superficielle, le cortex thymique, où se déroule la sélection positive, et la médulla où se déroule la sélection négative.
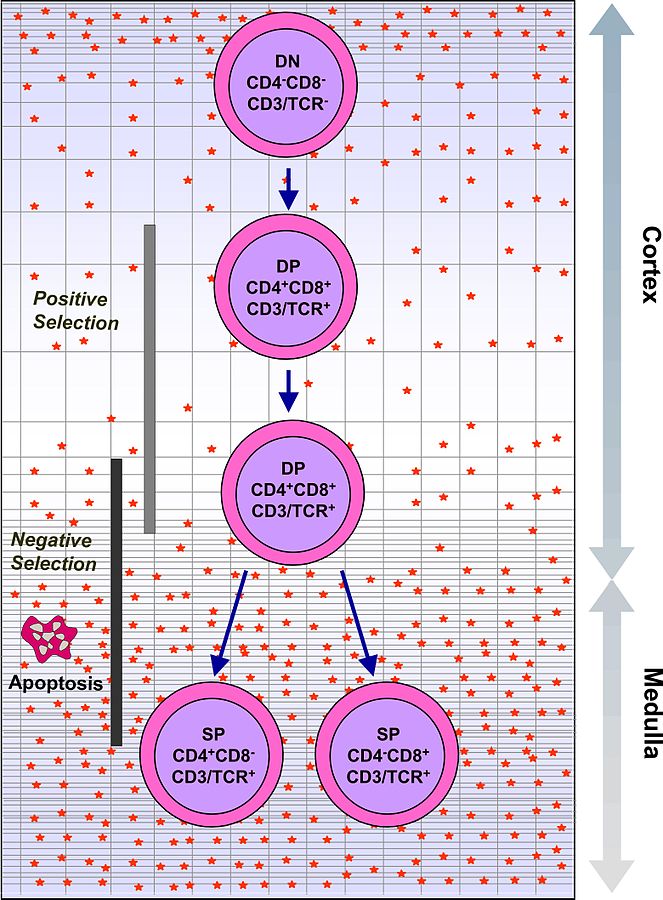
Sélection positive
On a vu que les lymphocytes doivent reconnaître le CMH. En effet, puisqu’ils reconnaissent des complexes CMH-peptides, il est nécessaire que les lymphocytes puissent avoir une capacité à se lier au CMH. Le peptide présenté augmente ensuite ou non l’affinité du TCR pour le CMH, mais, on peut grossièrement déjà se dire que si de base le lymphocyte ne reconnaît pas le CMH, il ne servira à rien.
Les lymphocytes T en cours de maturation, sont dans un état tel qu’ils doivent avoir un signal d’activation de leur TCR, faute de quoi ils dégénéreront. À ce stade, peu importe les peptides présentés par les cellules du thymus car seul l’interaction TCR-CMH est testée. Pour cela, les cellules du cortex thymiques présentent des peptides différents que les peptides auxquels les lymphocytes seront exposés plus tard, dans leur vie de lymphocytes. Les peptides proviennent de protéines cellulaires qui subissent un apprêtement différent que dans le reste du corps, de sorte que les peptides présentés sur les CMH-I et CMH-II sont comme des peptides privés.
Ainsi, ce que le cortex thymique teste est effectivement la capacité des lymphocytes à reconnaître, au moins avec une faible affinité, le CMH. Un lymphocyte qui est capable de lier au moins faiblement le CMH réussit le premier stade de sélection, d’où le concept de sélection positive. L’engagement de leur TCR fournit un signal qui promeut la survie du lymphocyte et qui lui permet de continuer sa maturation au stade suivant.
Sélection négative
Les lymphocytes restant deviennent un peu plus mature et cela va changer leurs réponses à une activation de leur TCR. En effet, au cours de la sélection négative, les lymphocytes activés dégénéreront.
Les lymphocytes quittent la zone superficielle du thymus (le cortex) et entrent dans la médulla thymique. Dans cette zone du thymus, les cellules vont présenter l’ensemble des peptides du soi. Les cellules thymiques présentent en effet des capacités d’expression génétique particulières, de sorte qu’une cellule va produire de très nombreuses protéines de l’organisme et ainsi présenter de très nombreux peptides du soi. L’expression de toutes ces protéines se faisant au hasard, sur l’ensemble de la médulla thymique, les lymphocytes seront exposés à la totalité des peptides du soi.
Comme on l’a dit précédemment, à ce niveau, les lymphocytes sont dans un état tel que l’engagement de leur TCR déclenche la mort du lymphocyte. Ainsi, à la sortie du thymus, les lymphocytes autoréactifs ont été éliminés et ne restent que les lymphocytes dirigés contre le non-soi. C’est le concept de sélection négative.
À la sortie du thymus, les lymphocytes reçoivent un nouveau signal leur permettant de continuer leur différenciation ; les lymphocytes ressortant sont des lymphocytes naïfs, n’ayant jamais rencontré leur antigène mais capables de reconnaître leur cible.
Activation des lymphocytes
Pour terminer cet article concernant la détection du non-soi, il nous reste à faire fonctionner le système immunitaire adaptatif. Nous avons en effet déjà vu les grandes lignes du fonctionnement du système immunitaire inné, mais concernant le système immunitaire adaptatif il nous reste à comprendre le déroulement de la réponse.
Nous allons donc remettre en ordre le tout maintenant que nous avons une meilleure compréhension des cellules impliquées dans la réponse adaptative.
L’activation des lymphocytes nécessite plusieurs signaux
Les lymphocytes qui n’ont jamais rencontré leur antigène sont dans un état dit naïf, c’est-à-dire qu’ils ne sont pas actifs mais en outre, qu’ils sont difficiles à activer. On peut voir ça grosso modo comme une sécurité : il y a toujours un risque d’avoir des lymphocytes autoréactifs, sans compter que la sélection négative ne concerne que les peptides du soi mais pas les peptides du non-soi inoffensifs (pour reprendre un exemple précédent : le pollen).
L’organisme s’assure donc qu’il fait bien d’activer ce lymphocyte par le verrou des 3 signaux nécessaires à son activation :
- l’engagement de son TCR ou de son BCR ;
- des molécules de co-stimulation fournies par une cellule auxiliaire ;
- des cytokines qui fournissent un 3e signal d’engagement.
À notre niveau, pour le moment, nous n’avons pas les connaissances pour comprendre pleinement le rôle du 3e signal, les cytokines. Nous nous contenterons simplement de dire que ce signal est requis pour l’activation des lymphocytes naïfs.
A contrario, un lymphocyte mémoire, c’est-à-dire issu de la prolifération de lymphocytes activés, n’a plus besoin que du premier signal, celui de son TCR ou BCR. Il a déjà fait ses preuves, son activation a été validée.
L’activation des T CD4
Nous avons déjà évoqué leur rôle d’auxiliaires. En effet, ils seront capables de fournir les signaux de co-stimulation aux autres lymphocytes dont seuls les BCR ou TCR ont été activés.
C’est avec la théorie des 3 signaux qu’on peut expliquer que parmi les cellules présentatrices d’antigène, seules les cellules dendritiques peuvent activer des T CD4. En effet, in vivo seules les cDC peuvent fournir les 3. Après leur activation dans les tissus en réponse à la présence de PAMP, les cDC migrent dans les ganglions où elles rencontrent les T CD4. Dans le même temps, la cellule dendritique exprime les autres protéines de co-stimulation telles que CD80 et CD86 et des cytokines. Un T CD4 qui reconnaît l’antigène se fixe donc sur la cDC et la cellule dendritique lui fournit également les autres signaux de co-stimulation. Le T CD4 est alors activé et pourra fournir des signaux aux autres cellules présentatrices d’antigènes. Avant cela, il entre en prolifération, de sorte qu’il augmente la probabilité que chaque CPA exposant son antigène puisse recevoir les bons signaux.
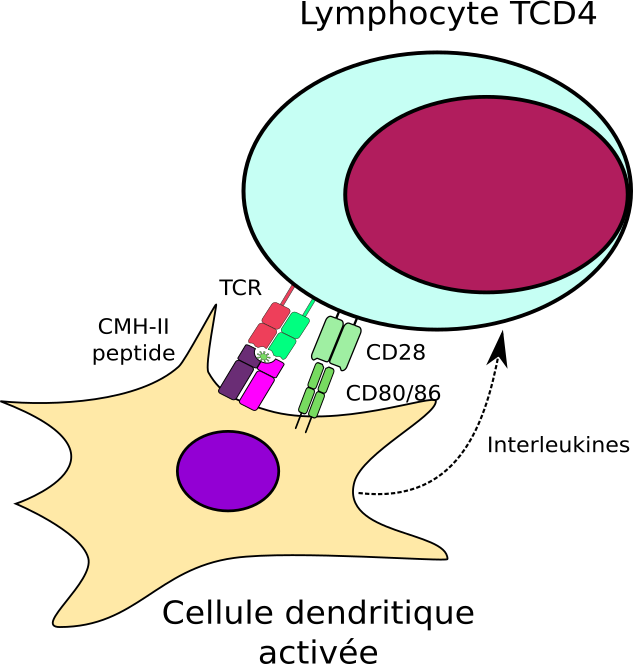
Cela nous amène à parler de l’activation des lymphocytes B.
L’activation des B
De la même façon, les lymphocytes B reconnaissent leur antigène au niveau des ganglions lymphatiques. Un B qui fixe par son BCR l’antigène internalise le complexe BCR-antigène et donc récupère l’antigène depuis le milieu extérieur. D’une part, cela fournit le premier signal, d’autre part le B est alors capable de présenter sur le CMH-II l’antigène. Il peut donc recevoir l’aide d’un lymphocyte T CD4 qui a déjà été activé au préalable et qui lui fournit les signaux manquants. Le lymphocyte B entre alors en prolifération.
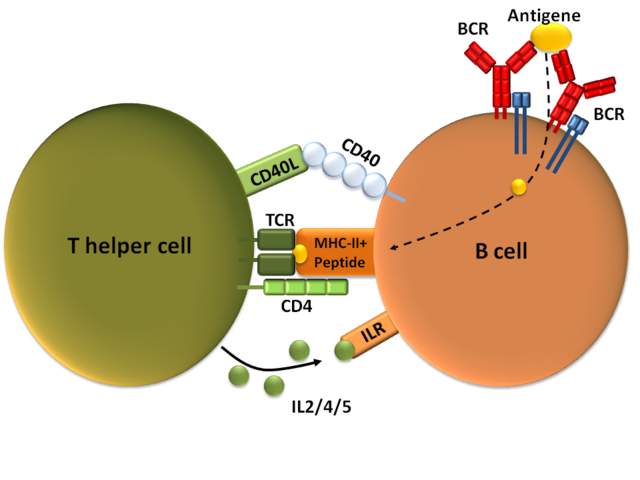
Parmi les lymphocytes B qui prolifèrent, certains deviennent des plasmocytes producteurs d’anticorps et d’autres deviennent des lymphocytes B mémoire. Les anticorps produits correspondent au BCR sans le domaine d’ancrage à la membrane.
Pour terminer sur le rôle des T CD4 sur les cellules présentatrices d’antigène, il faut savoir que les macrophages, les autres cellules capables de présenter sur CMH-II, peuvent aussi recevoir des signaux des lymphocytes T CD4 qui stimulent leur activité. Parmi les lymphocytes T CD4 qui reconnaissent les peptides présentés par les macrophages, certains sécréteront des signaux autorisant le macrophage à être encore plus actif quant à son activité de phagocytose pour augmenter l’efficacité de l’action des macrophages. D’autres vont sécréter des cytokines attirant les neutrophiles depuis le sang, ce qui permet d’avoir une grande population de cellules phagocytaires et augmentent également l’efficacité du système immunitaire inné à cet endroit. C’est ainsi que les lymphocytes T CD4 permettent le déroulement de la réponse immunitaire.
Activation des T CD8
Il a également lieu grâce aux cellules dendritiques. Les cDC présentent en effet des capacités à être infectés par la plupart des virus, de sorte qu’elles pourront présenter des peptides intracellulaires du non-soi sur le CMH-I. Ainsi, les cDC peuvent activer des T CD8 par, encore une fois, la présentation de peptides du non-soi et en fournissant encore les signaux de co-stimulation. L’activation des T cytotoxiques est très similaire à celle des T CD4, la seule différence étant l’interaction entre le TCR, CD8 et le CMH-I de la cellule dendritique.
On pourrait se dire que si jamais on tombe sur un virus ou une bactérie intracellulaire qui n’infecte pas les cellules dendritiques malgré leur grande permissivité aux virus, on serait cuit. Pas de possibilité d’avoir une réponse cytotoxique, nécessaire pourtant face à de tels agents ! Fort heureusement, les cellules dendritiques complètent leur capacité à présenter des peptides du non-soi sur le CMH-I grâce à la présentation croisée.
Certaines cellules dendritiques sont en effet autorisées, à titre exceptionnel, à adresser les peptides extracellulaires sur le CMH-I. Ainsi, un virus qui n’infecterait pas les cDC se retrouverait néanmoins à un moment à portée d’une cellule dendritique ou au moins un fragment du virus. Cette cellule récupérerait au moins un de ses antigènes et l’adresserait sur le CMH-I comme si cet antigène était d’origine intracellulaire.
Ainsi, certaines populations de cellules dendritiques sont autorisées à avoir un tel comportement dans l’optique d’augmenter les chances de repérer l’antigène. Les autres cellules ne peuvent, elles, qu’adresser les peptides intracellulaires sur le CMH-I, de sorte que le CMH-I conserve son rôle de reflet de l’état d’infection de la cellule. Cela complète le panel d’antigènes pouvant amener à une réponse cytotoxique.
Nous avons abordé dans ce texte les récepteurs de l’immunité innée et ceux de l’immunité adaptative. Comme nous l’avons vu, l’immunité innée reconnaît plutôt des familles de molécules associées aux pathogènes tandis que les récepteurs de l’immunité adaptative vont avoir une spécificité contre un antigène. La sélection des récepteurs de l’immunité innée s’est donc faite au cours de l’évolution et a permis l’émergence de récepteurs à des motifs que les pathogènes ont eu du mal à changer au cours de leur évolution ; l’immunité adaptative générant des récepteurs aléatoirement, il est nécessaire qu’il y ait un processus actif de sélection. La sélection des lymphocytes T est beaucoup plus stricte que celle des B : c’est à mettre en relation avec le processus d’activation des B qui ont besoin des T.
Ainsi, le système immunitaire est capable de reconnaître le soi du non-soi. Nous avons peu discuté de la reconnaissance du soi-modifié, mais on peut d’ores et déjà pensé avec ce que nous avons vu que cela a un rapport avec le CMH de classe I porté par la plupart des cellules de l’organisme.
Mais bien entendu, le monde de l’immunologie est encore très vaste. Les grandes populations de cellules que nous avons vu peuvent encore être découpées en sous-familles avec chacune son propre rôle ; nous avons entraperçu le rôle des cytokines tout en mentionnant qu’elles jouent un grand rôle que nous n’avons pas vu ensemble dans l’activation des lymphocytes par exemple. Parmi tant d’autres choses.
Je terminerai par mentionner le fait qu’il n’y a pas que des anticorps contre des peptides (mais contre des sucres complexes par exemple), ni que des systèmes de présentation de peptides : on peut par exemple mentionner l’existence de système de présentation de lipides ou de métabolites de vitamines. Naturellement, de la même façon que précédemment, ces systèmes vont présenter des molécules du non-soi ; ils vont permettre l’activation de sous-populations de cellules immunitaires particulières et participent ainsi à la réponse immunitaire.
Livres ayant servi de référence lors de l’écriture de l’article :
- Immunobiologie, Janeway et co-auteurs, De Boeck, 3e edition (2009)
- Immunologie - Le cours de Janis Kuby, Owen, Punt et Stranford, Dunod, 7e édition (2014)
Illustration de l’article : depuis Wikicommons
Merci beaucoup à Taurre pour la relecture et ses conseils ! 

 (par contre, n’aurait-il pas été préférable d’en faire un mini-tuto ?)
(par contre, n’aurait-il pas été préférable d’en faire un mini-tuto ?)

