Bonjour à tous ,
Comme à mon habitude je me plonge dans la chimie organique fréquemment, encore plus quand celle-ci fait intervenir des réactifs de grignards  .
.
Sur les exo sur lesquelles je bosse : habituellement il y a les stereoisomère/enantiomères (affiché à la correction) qui se forme tout au long des étapes, lorsque ces dernières ne sont pas enantioselective.
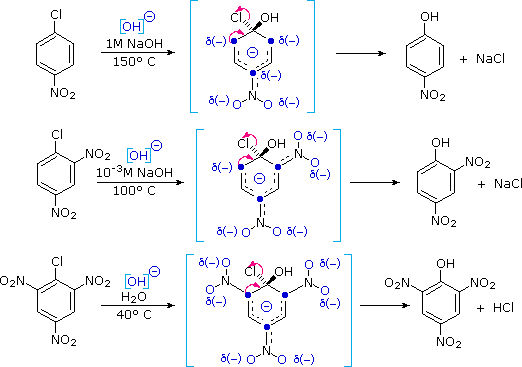
Mais ici sur mon cas c'est un peu particulier. L'organomagnésiens réagit avec une cétone entre 2 cycle aromatique.
Sur l'un des cycle aromatique il y a un Chlore. J'ai pensais qu'il allait (le réactif de grignard) préférer finir sa course dans les mains du chlore ? Au même les deux ?
Or il n'ai montré, dans la correction, qu'une forme finale (vue qu'il y a déshydratation de l'alcool tertiaire, et donc formation d'une liaison Pi, ils écrivent tout de même l'existence d'isomère Z et E)
Sans que le chlore ne soit touché…
D'ailleurs je soupçonne une erreur car le chlore disparait par magie entre 'le corrigé des étapes' et 'la forme finale de la molécule'.
(J'avais écrit un tout beau texte tantot… mais par mégarde j'ai fermé la fenêtre du navigateur… et j'ai pommé mon message, étant un peu pressé et dégouté, excusé ma rapidité dans les propos)
Merci pour vos futures réponses les amis,
Bien confraternellement,
Blackline.

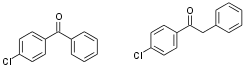
 (ceci dit, comme il s'agit d'un machin qui semble industriel, je dirais qu'il y a pas de colonne à faire).
(ceci dit, comme il s'agit d'un machin qui semble industriel, je dirais qu'il y a pas de colonne à faire).