Bonjour !
On étudie le processus irréversible et isobare suivant :
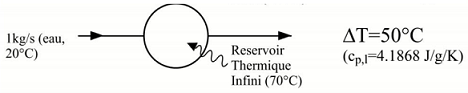
On demande de calculer la variation d’entropie massique du fluide principal (Δs).
Le fluide est supposé incompressible.
Ma démarche
Le fluide principal, c’est l’eau et c’est un corps pur.
Par conséquent, en utilisant la formule de cette page :
Δs=∫20°C70°Ccp,lTdT=cp,lln(2070)=5,245 kg.KkJ
Ce que propose mon corrigé
Mon corrigé utilise les deux formules suivantes :
Δs=T0q cp,lΔT=q
Il en déduit :
Δs=T0cp,lΔT=293,1550×cp,l=659 kg.KJ
Je ne suis pas d’accord avec mon corrigé car le processus étant irréversible, il est interdit d’utiliser cette formule :
dS=TδQreˊv
Qui a raison ?
+0
-0

