Coucou,
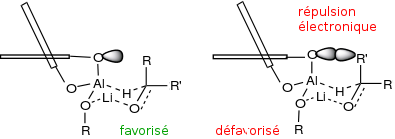
Dans la réduction énantioséléctive d'une cétone je demande le père. J'en reviens souvent à cette question n'est-ce pas ? Alors dans l'étude de la sélectivité d'énantiomère obtenue j'étudie une transition de chaise à l'aide de LiAlH4 et du Bi-naphtol tel que :
Ce type de formation me pose problème car on remarque que l'Alkyl de 5 carbones est en position axiale or, on sait que généralement d'après ce diagramme, que les substituants les plus encombrés sont en équatorial :

R' est-il plus encombré que R ? Ai-je compris de travers un truc ?
Merci pour votre lecture.
+0
-0