Bonjour à tous,
Comme à mon habitude, je travail encore sur le pseudoephedrine et sa synthèse à partir de levure ce coups-ci.
Nous obtenons :
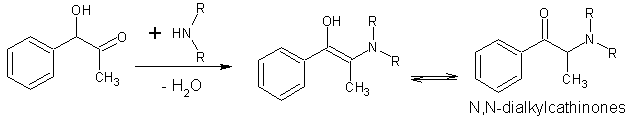
Mais voilà, il est possible de faire une interconversion pour passer du L-Pac à la forme 2-hydroxy-1-phenyl-propan-1-one. Pour ce faire on peut utiliser une base ou un acide (je ne sais pas trop comment ça fonctionne si vous aviez des idées/indices  ). Cette interconversion peut changer la configuration de l'acool, R en S. Donc ça permettrais d'obtenir la pseudoephedrine après imination reductrice.
). Cette interconversion peut changer la configuration de l'acool, R en S. Donc ça permettrais d'obtenir la pseudoephedrine après imination reductrice.
Mais vue qu'on cherche un Alcool sur le carbone alpha, et qu'il doit se trouver derrière j'ai imaginé que : Puisque l'Alcool polarise le carbone alpha, qui a sa charge positive stabilisé par le cycle, alors peut-être pouvait-il réagir ? En effet il y a en solution présence de HCl, qui sert à créer du H2 in situ. Il pourrait très bien attaquer l'amine puis former une énamine ? On obtiendrais donc un racémique pour une bonne raison.
Qu'en pensez vous ? Je fabule ?
Merci pour votre temps accordé.
Bonne Année à tous