Merci pour vos réponses , alors cependant j'ai encore quelques questions :
De rien, on progresse collectivement. 
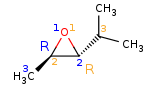
Le prof m'avait dit que le carbone 1 de (A) et (B) a le même agencement spatial des substituants, ces 2 carbones devraient donc avoir la même configuration absolue. ( mais cette remarque serait plus adaptée au carbone 2 non ? moi je pense que Pierre a raison sur les configurations absolues des C1 et C2 des 2 époxydes de départ)…
Je suis d'accord avec vous, c'est les carbones 2 qui ont la même configuration absolue.
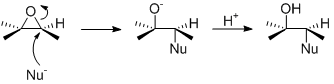
Alors pour les produits formés, il faudrait pas OH à la place du O- ?
Si tu parles de mes exemples, ils finissent tous avec OH. 
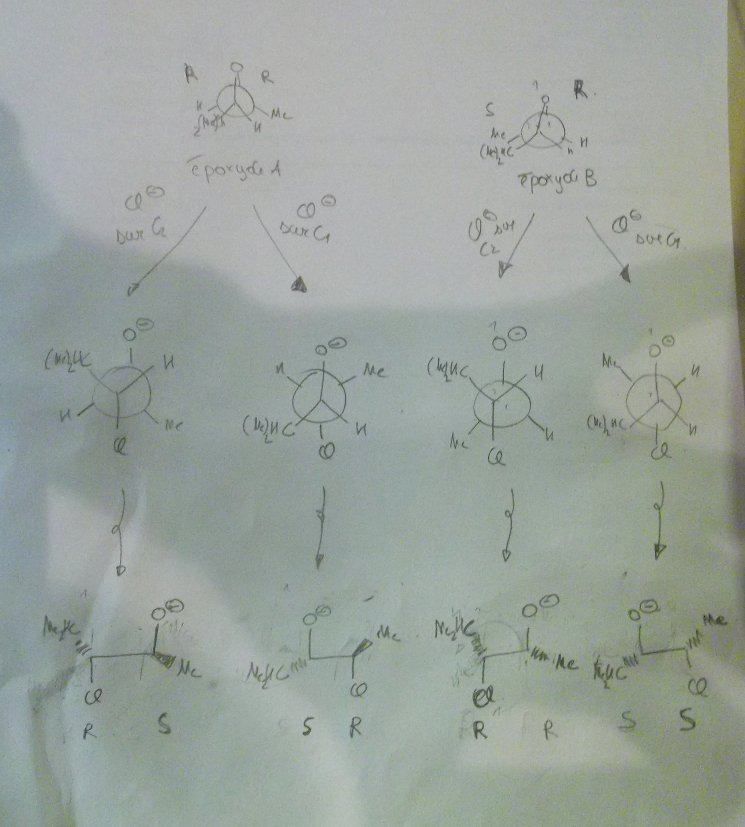
Si on attribue les descriptifs thréo et érythro aux produits formés, érythro ca serait pour les produits RS et SR et thréo pour SS, RR ?
Désolé je n'ai pas revu ça depuis des lustres, il faudrait que je vérifie. Franchement ce ne sont pas des définitions couramment utilisées…
d'après l'énoncé une des 2 réactions est régiosélective, il faut préciser laquelle et justifier.
Mon prof m'avait donc dit que pour les produits du A, l'attaque sur le carbone 1 et le carbone 2 était plus ou moins équiprobable.
Déjà d'après-moi les 2 sont régiosélectives car dans tant A que B ont des substituants différents à gauche et à droite. Donc forcément l'encombrement/stabilisation n'est pas le même à gauche et à droite et donc forcément il y a de la régiosélectivité.
Par contre, concernant l'attaque sur le substrat (B) le
chlorure s'additionnera très préférentiellement sur le carbone 2 à cause d'un
moindre encombrement
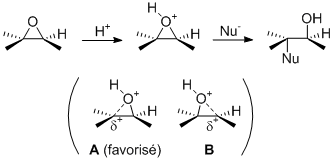
Euh tu voulais pas dire carbone 1 par hasard? C'est lui le moins encombré. Encore une fois, il attaque bien le moins encombré si on est en milieu basique. Or avec HCl, on est acide. Bon, ok, en pratique la différence de stabilisation d'un carbocation par Me ou iPr est peut-être tellement faible que l'encombrement prend le dessus comme dans le cas basique. Mais encore une fois, ce genre de raisonnement tordu prouve que ces exemples sont foireux et prêtent à confusion.
Mais là je n'arrive pas du tout à voir ça, et il y a le fait le problème de la réaction en milieu basique et acide…
A mon avis ton prof ne connaît pas le problème acide/base dans l'ouverture des époxides…
Je réalise que mes réponses ne t'aident pas à donner les réponses que ton prof attend. J'en suis désolé mais j'ai vraiment l'impression que le problème vient de lui. Pour la suite de ton parcours, je te conseille de bien examiner les deux schémas de mon message précédent et voir s'ils te semblent logiques. Et en attendant, demande plus de précisions à ton prof (et s'il est au courant de la problématique acide/base).