Bonjour tout le monde 
La rentrée s'approche doucement, et puisque je suis maintenant de l'autre côté de la barrière1, il est temps que je prépare mes exercices. Or, dans un d'eux, il est nécessaire de calculer la force des ponts H entre deux molécules.
Je fait donc tourner GAMESS et, en phase gazeuse et à un niveau de calcul pas très élevé mais correct2, j'obtient les énergies suivantes:
| Donneur | Accepteur | Energie (kj mol-1) | Enthalpie via Wikipedia (kj mol-1) |
|---|---|---|---|
| H2O | H2O | -16 | - 21 |
| NH3 | NH3 | -9 | -13 |
| H2O | NH3 | -20 | -29 |
Énergie des ponts hydrogènes, calculée comme $E = E_{dim} - E_D - E_A$. Le donneur de pont H a son hydrogène pointé vers l'atome électronégatif de l'accepteur (voir ci-dessous). Les chiffres de "Wikipedia" sont issus de cette page. Tout est en phase gazeuse.
Ce qui m'étonne un peu, c'est bien entendu la dernière ligne, sauf que vous pouvez constater que je suis dans l'ordre d'idée donné par Wikipédia, donc il ne s'agit pas d'une erreur de calcul de ma part (je pourrait m'amuser à monter plus haut en méthode de calcul, mais ça va me bouffer du temps pour rien).
Pourquoi est ce qu'un pont H est plus fort entre H2O et NH3 ? Je trouve ça personnellement contre intuitif, et ce pour deux raisons: l'oxygène est plus électronégatif que l'azote, donc techniquement, l'eau devrait plus attirer l'hydrogène de son voisin et former des ponts hydrogènes plus forts. D'autre part, si on résonne en terme d'acidité, H2O est plus acide que NH3, donc ça me conduit à la même conclusion.
Qu'est ce que j'ai raté ?
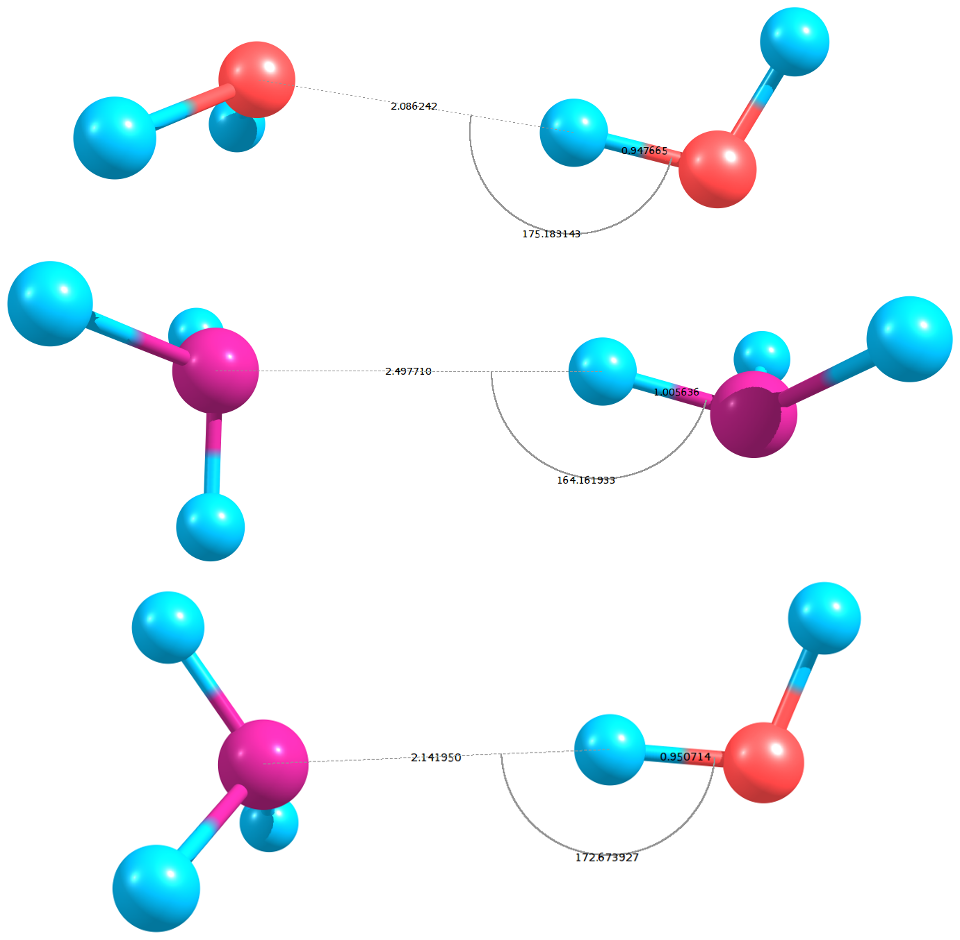
EDIT: et voilà les paramètres géométriques, faites pas attention aux couleurs, l'hydrogène est en bleu et l'azote en mauve :

 mea culpa si c'est HS
mea culpa si c'est HS

