Pour ta mésomérie, tu dois prendre en compte le fait que ton élément doit être relativement stable lorsqu'il a cédé ou récupéré des électrons. Dans un cas, tu forces la création d'un O+ et d'un carbanion, dans l'autre un carbocation et un O-.
Ce qu'il faut bien comprendre avec la mésomérie, cc'est qu'elle signifie que la représentation avec les liaisons (simples ou doubles ou triples) et les doublets non liants ne sont qu'une vue de l'esprit et que la molécule existe dans un « mélange » de tous les différents mésomères possibles. Mais certaines formes sont nettement moins probables que d'autres car associées à un potentiel énergétique bien trop peu favorable.
Le O+ est très instable donc la forme mésomérique où il apparaît ne doit être que minoritaire si ce n'est ne même pas exister, parce que le O ne respecte pas la règle de l'octet. Quand tu formes O-, là c'est mieux, parce que les éléments se retrouvent dans des états relativement stables malgré les déplacements d'électrons.
Et tant qu'on y est, tu peux encore faire de la mésomérie avec ton soufre (je me doute que c'était jjuste pour l'exemple mais à titre d'info…)
Réfléchissons : si un groupe subit l'effet mésomère attracteur, il aura tendance à se faire prendre ses doublets. Du coup, il cherchera plus à les "récupérer", ce qui fait de lui un électrophile, right ? Et inversement pour un nucléophile. Par rapport au carbocation, il s'agit d'un nucléophile : il serait donc stabilisé par des effets mésomères donneurs ?
Ne raisonnne pas en terme "attracteur". Il est prêt à céder ses électrons ou pas. Donnneur ou accepteur est plus précis pour bien fixer les idées.
La mésomérie c'est un déplacement d'électrons. La nucléophilie ou électrophilie c'est aussi une affaire d'électrons. Un bon nucléophile est riche en électrons, un électrophile pauvre, d'où les réactions possibles. Tu es sur la bonne voie, je rajoute des question. Si des électrons d'un nucléophile se barrent, que lui arrive-t-il du coup ? Même question pour un électrophile qui récupère des électrons.
Par rapport au carbocation, il s'agit d'un nucléophile : il serait donc stabilisé par des effets mésomères donneurs ?
Un carbocation nucléophile ? Quelle horreur ! Cela dit, y'a l'idée, mais : si il peut être stabilisé par mésomérie, y'a-t-il des chances de le trouver sous forme carbocation ? (cf discours avant).
EDIT : bon bah je suis trop lent. Tant pis pour vous.
 ,
,



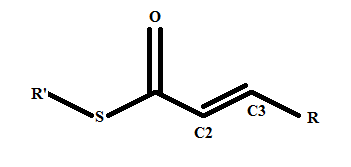
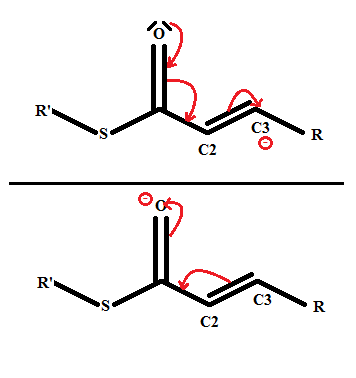
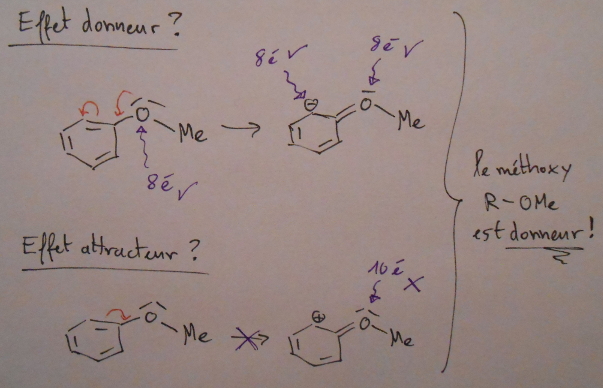
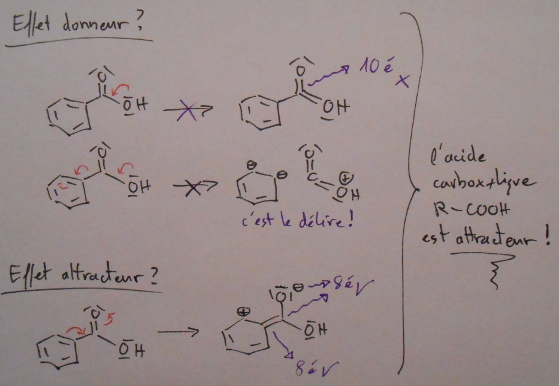
 . Je ne suis simplement pas allé au bout des choses
. Je ne suis simplement pas allé au bout des choses 