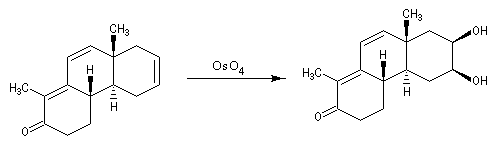Bonjour à tous!
Je voyais justement Sotibio qui pose une question sur la nucléophilie et j’en ai une similaire mais on parlera plutôt de stéréoselectivité/regioselectivité. Je viens d’avoir mon examen de chimie organique et j’ai eu une réaction qui m’a un peu perturbé.
Il s’agit des deux réactions suivantes: http://cl.ly/2S1U3J030F2h
[J'ai jamais réussi à mettre une image ici…Je sais pas comment ça se fait.]
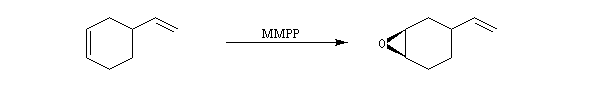
(dihydroxylation à l’osmium et formation d’un époxyde avec le m-CPBA).
Sur l’image au-dessus c’est ce que j’ai mis mais j’ai eu des gros doutes surtout pour l’osmium. J’ai réfléchi comme suit:
-
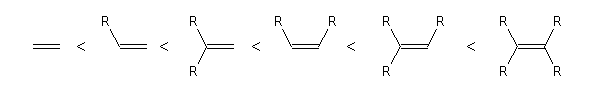
Pour l’époxydation, l’instauration la plus substituée va attaquer vers l’oxygène électropositif du m-CPBA car là cause de l’effet inductif des groupement Me et Et ce qui augmente sa nucléophilie.
-
Pour la dihydroxylation, j’ai eu beaucoup plus de doutes car au niveau de la double liaison à gauche on a très peu d’encombrement stérique. En voyant le mécanisme avec l’osmium, j’ai l’impression que l’encombrement stérique défavorise la réaction. D’un autre côté, vu que la réaction est syn-stéréospécifique, je me dis que ça peut très bien attaquer sur la double liaison la plus substituée car les substituants se mettront vers l’avant et les oxygènes avec l’osmium à l’arrière du plan (ou vice versa)
Je sais que c’est très flou mais c’est parce que ce n’est pas clair pour moi non plus 
Edit: On a bien un seul équivalent de chaque produit 
Merci d'avance !