Bonjour,
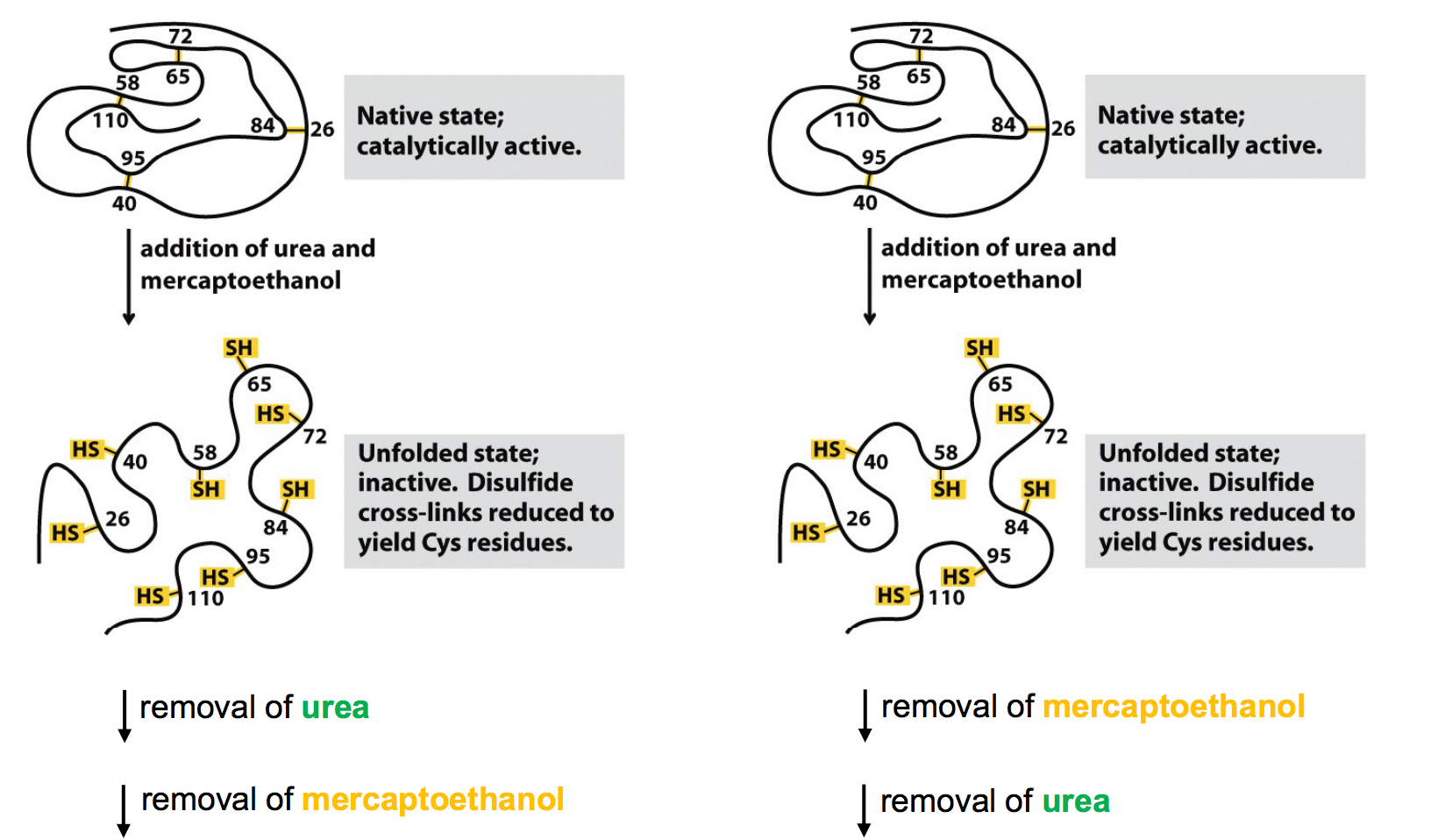
Je ne comprends pas très bien le schéma suivant et ce qu'il signifie concernant l'importance des liaisons disulfures. En gros si on enlève d'abord le mercaptoethanol et puis l'urée, la ribonucléase a seulement 1% de l’activité de l’enzyme native tandis que si on fait le contraire on obtient 100%. Enlever le mercaptoethanol devrait créer les liaisons S-S de nouveau et enlever l'urée devrait rompre les liaisons non-covalentes (liaisons hydrogène, van der walls, …) donc on recasse de nouveau les S-S c'est ça ?
+0
-0

