Pour les fans de chimie, ou les curieux du "DIY" vous voici dans un tutoriel ayant pour sujet "la galalithe" (ou pierre de lait). Une matière plastique aux multiples avantages qui peut être utile comme intéressante d'apprendre à connaitre. Il vous sera proposé tout au long de ce tuto une découverte progressive des outils scientifiques qui vous permettront de comprendre intégralement les manipulations, ainsi que bien entendu les manipulations elles-mêmes qui seront sans danger.
Le déroulement du tutoriel :
Commençons par la composition
Nous parlons ici de faire une matière plastique biodégradable et facile à faire chez soi. Si vous avez déjà eu l'occasion de lire des pages web sur la galalithe, vous avez sûrement déjà eu un peu peur en entendant le mot formol, par exemple. Or ici le formol ne sera que cité pour illustrer certains propos. Ici tout est organisé pour que les manipulations et les produits utilisés soient sans danger. Il suffira donc de suivre les précautions détaillées lors des manipulations. Il n'est pas nécessaire d'avoir un diplôme, ni de laboratoire pour suivre les protocoles présentés. Une cuisine bien entretenue, du courage pour lire ces lignes, et c'est parti !
Qu'allons nous faire ?
Nous allons extraire une protéine d'un produit organique connu, ce qui ne va pas être une sinécure. Nous pouvons d’ores et déjà supposer que nous allons travailler avec du lait, puisque le mot galalithe vient du grec gala = lait et lithos = pierre et en plus, par un hasard fabuleux, le nom du tutoriel spoil le sujet de notre future investigation !
Donc introduisons d'abord ce dernier (le lait) avant d'aller plus loin.
Le lait, un mélange complexe
Le lait est un liquide d'aspect homogène, blanc (c'est tout joli, surtout avec des céréales  ) et on peut parfois y observer des bulles en surface. Nous savons aussi que si le lait est mal conservé il peut engendrer le développement de Salmonella (provoquant la salmonellose) ou même contenir des staphylocoques. Il est donc impératif pour notre manipulation d'avoir un lait bien conservé dès l'origine.
Le lait contient aussi des Lactobacilles, bactéries qui transforment les sucres du lait, à long terme et à température ambiante, en acide !
) et on peut parfois y observer des bulles en surface. Nous savons aussi que si le lait est mal conservé il peut engendrer le développement de Salmonella (provoquant la salmonellose) ou même contenir des staphylocoques. Il est donc impératif pour notre manipulation d'avoir un lait bien conservé dès l'origine.
Le lait contient aussi des Lactobacilles, bactéries qui transforment les sucres du lait, à long terme et à température ambiante, en acide !
Le lait contient : eau, protéines (Albumine, Globuline, Caséines), matières grasses (lipides), sucre (Lactose, Galactose) et de potentiels Micro-Organismes (MO).
On constate premièrement qu'il y a mélange de matières grasses et d'eau. Cela vous évoque t-il quelque chose ?
L'huile + l'eau, ça fait 2 ?
Je crois bien que l'on se souvient tous de l'expérience suivante : verser de l'huile sur de l'eau dans un verre et observer que l'huile, plus légère et non-miscible à l'eau, créé une "phase" de séparation avec l'eau, tel que :

On constate que dans le verre, il y a deux liquides bien distinctement séparés.
On peut prévoir ce genre de phénomène par ce qu'on appelle en chimie, la polarité. Les graisses, essences, matières plastiques sont généralement apolaires (n'ont pas de polarité). L'eau, le verre, les protéines, les sucres, le papier sont polaires (contiennent des pôles + et -)
Les pôles cités ici n'ont rien à voir avec les pôles Nord/Sud des aimants. A l'instar de ces derniers, deux pôles identiques se rejettent et deux pôles contraires s'attirent, mais le phénomène enfantant ces pôles n'est pas du tout le même.
Comment deux de ces composants si différents, qui ne sont d'ordinaire pas miscibles, le deviennent-ils ?
Vous en avez un exemple dans la vie de tout les jours, juste avant de manger. Vous utilisez un objet qui solubilise les produits polaires et apolaires entre eux ! Il s'agit du savon et l'on appelle cette caractéristique une capacité tensioactive.
Le savon, tout comme la caséine, possède des zones qui attirent différentes polarités. La tête du savon par exemple est polaire, permettant d'aller dans l'eau, tandis que la queue du savon elle est apolaire et permet de se lier aux graisses. De ce fait, on comprend vite le rôle de la caséine dans le lait : créer une cohésion entre les lipides et le solvant (l'eau).
La Caséine, pas une mince affaire
On va un peu étudier à quoi ressemble la caséine. Bien entendu, on ne va pas réellement s’intéresser à chaque atome de la protéine, mais à une représentation de celle-ci.
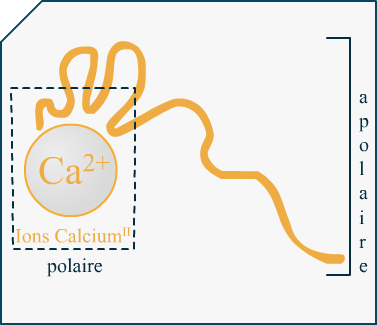
On voit sur le schéma simplifié une sorte de ver de terre orange, qui a l'air de se replier sur une sphère. La sphère est la représentation des atomes de calcium (notés Ca2+ : chargés positivement). Quant au ver de terre, c'est la protéine, la tant attendue caséine. Elle est chargée négativement sur certaines zones. On dit que les zones sont polarisées, et de la même manière qu'un aimant (à noter qu'ici il n'y a pas de réelles interactions magnétiques) les contraires s'attirent, ce qui créé un repliement des zones négatives autour des atomes de calcium positifs.
Pour supprimer cette zone polaire (et donc insolubiliser la caséine de l'eau) nous allons devoir remplacer les ions calciums, car le calcium et la protéine forment des "liaisons polaires" (ioniques) avec des charges + et -, créant une cohésion avec l'eau. Pour éviter ce genre d'interactions nous allons utiliser d'autres types de liaisons, des liaisons qui sont neutres. C'est avec cette idée que nous allons arracher les Ca2+ et les remplacer par quelque chose de plus stable.
Pourquoi supprimer cette zone polaire ?
On a expliqué tout à l'heure qu'il était anormal que le lait soit un mélange homogène de matière non-miscible et que le rôle de la caséine était de créer une cohésion entre les lipides et l'eau.
Dans l'introduction, on précise que le but de la manœuvre est, ici, d'extraire une protéine. La protéine que l'on va donc devoir extraire est la caséine (comment ça aucun suspens ?  ).
).
En supprimant cette zone polaire nous allons l'extraire de l'eau. Elle ne serait ainsi plus soluble dans l'eau et précipiterait.
L'avez vous vu venir ?
Notre périple n'est pas fini, et j'attire votre attention sur un problème : Si nous dé-solubilisons la caséine de l'eau : quel est le problème ?
Afficher/Masquer le contenu masquéLa caséine deviendra intégralement liposoluble, et nous ne serons toujours pas tirés d'affaire !
C'est un assez gros problème, car avec un peu de bon sens on imagine tout de suite que si l'on souhaite créer une matière résistante, les lipides (graisses/huiles) ne sont clairement pas un plus pour notre projet. D'ailleurs, plus le mélange sera homogène, plus la galalithe sera résistante !
C'est donc à partir d'un autre produit laitier que nous allons extraire la caséine : le fromage blanc.
Pour la simple et bonne raison qu'il est disponible avec un taux de lipides nul. "Le fromage blanc 0% de matière grasse" est donc notre salut, mais est-il le seul ?
Le lait écrémé, comme son nom l'indique, ne possède plus de crème. Il est donc partiellement dépossédé de ses lipides. Vous pouvez utiliser du lait écrémé pour la suite des aventures, mais je vous conseille de vous fier au tutoriel si vous souhaitez obtenir un résultat similaire.
Extraction, réticulation et réflexion
Opération initiale à partir du lait
Tiens c'est vrai ça, pourquoi cela ne s'appelle-t-il pas casélithe, ou fromage-blanc-lithe, si avec du lait cela semble si compliqué ?
Pour comprendre l'origine du nom, il va nous falloir expliquer les procédés employés à cette époque. Vous allez le constater, ce n'est pas une mince affaire que de réussir une telle prouesse industrielle dans sa cuisine.
Tout d'abord, un peu d'histoire. Le découvreur de la galalithe, un français dénommé Auguste Trillat, consacre son temps d'autodidaxie en chimie au formol, un aldéhyde volatile très toxique.

Au XIXe siècle, il découvre une propriété étonnante au formol : il fait précipiter la caséine du lait en une pâte réellement intéressante. Durcie et coagulée, la caséine est parfaitement extractible, mais ses propriétés se voient changées. Elle est, après séchage, plus résistante qu'auparavant.
Il y a eu un changement dans la structure moléculaire de la caséine : le formol a réagi avec elle, donnant naissance à la vraie galalithe, issue du lait.
Cet homme en réalité venait d'extraire et de renforcer la caséine en un clin d’œil ! Ou plutôt en un tour de main car ce n'est pas si simple concrètement : il fallait en effet plonger 13 jours dans un bain de formol à 4 % des plaques immenses de caséine. Malgré tous ces efforts industriels (cuve immense, sécurité relative à l'utilisation du formol, création de plaque homogène…), ces manipulations, chimiquement, se limitaient à une et une seule réaction chimique.
Une réticulation est un procédé qui renforce les liens d'un polymère (entendre par là : protéine dans notre cas).
Par exemple pour le formol (en bleu marine) et la caséine (en orange) :
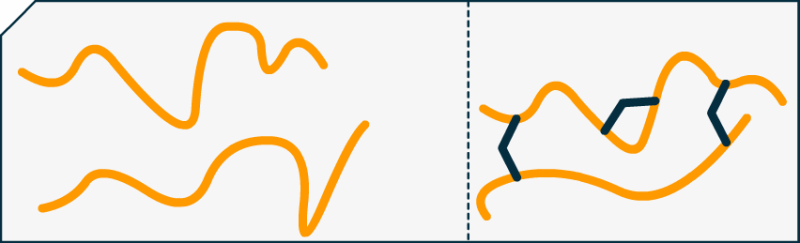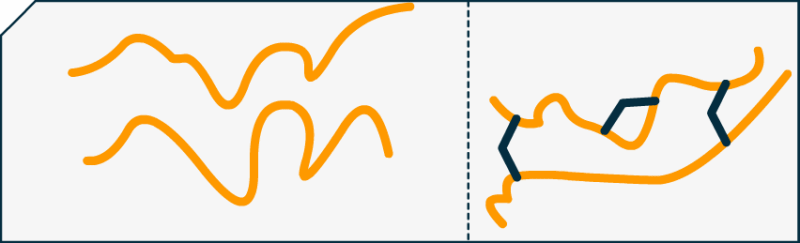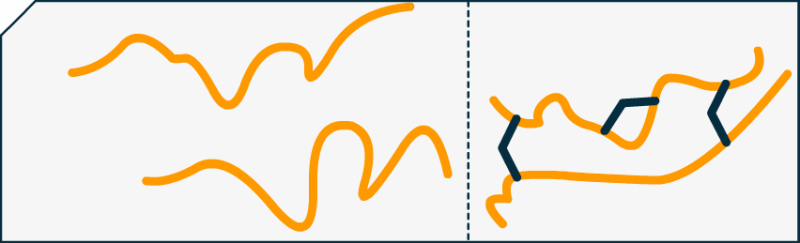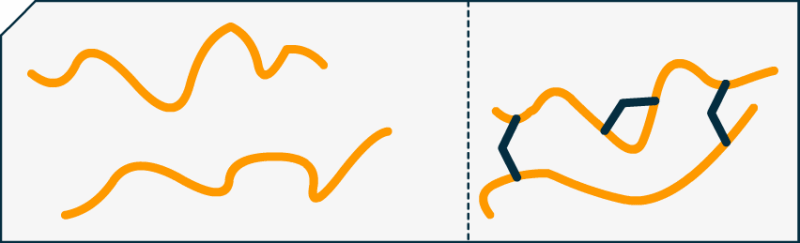
Nous constatons facilement que, sans la cohésion du formol (raccords bleus) les brins de protéines seraient plus libres de se mouvoir. Car ne l'oublions pas, à 25°C la matière vibre sans cesse et est en mouvement constant ! Pour avoir un plastique fort, il faut augmenter les contraintes entres les protéines (ou autre polymère) pour les empêcher de trop naviguer de manière désolidarisée.
Bon même sans réticulation, nos brins de protéines sont immensément grandes (on appelle ces grandes molécules des macromolécules), comparable à des spaghettis, on imagine tout de suite qu'une assiette de ces pattes sont bien difficile à démêler même sans formol ! (Attention, il ne doit jamais y avoir de formol dans vos spaghettis hein ! c'était une manière de parler  )
)
Notre démarche personnelle
Nous n'allons pas travailler, comme M. Trillat, avec du formol. Nous l'avons déjà expliqué ceci n'est qu'un renseignement. Il est bien trop dangereux et bien heureusement peu simple d'obtention.
Nous allons utiliser la chaleur pour insolubiliser la caséine de l'eau contenue dans le fromage blanc. Cette technique coagule (agglomère) les protéines pour faciliter l'extraction. En chauffant, nous obtiendrons une sorte de soupe grumeleuse. Suite à cela nous allons pouvoir extraire ce solide (protéine) du liquide (l'eau et les différentes matières).
Nous aurions pu modifier le pH du produit laitier en y ajoutant du vinaigre blanc (acide acétique). Mais cette technique ne propose finalement pas un énorme intérêt pour le moment. Nous verrons dans l'annexe (future) comment améliorer le protocole, pourquoi l'améliorer et quelles sont ses points faibles.
À partir de là nous n'aurons que de la caséine (ou autres protéines ajoutées). Mais il n'y a pas encore, à ce stade, d'opération de réticulation. Nous allons utiliser un procédé fonctionnel qui néanmoins ne va pas créer autant de contrainte mécanique. En effet nous n'allons pas utiliser des liaisons rigides (comme le formol le ferait) mais plutôt des liaisons proches de tension électrostatique. Vous imaginez alors que ces tensions sont bien faibles et permettrons quand même une souplesse intermoléculaire (les choses ne seraient donc pas figées). Mais c'est un moyen efficace et sans contrainte sécuritaire.
Nous allons utiliser le borax, un sel blanc, qui peut être reprotoxique. C'est pourquoi l'usage de gant est vivement conseillé (nous vous invitons d'ailleurs à consulter cet article pour plus de renseignements). Ce sel va donc créer des liaisons entre les brins de caséine, ces liaisons comparées aux rigides liaisons du formol peuvent être comparées à des ressorts entre les brins de protéine.
Liste de matériel et protocole
Ingrédients nécessaires
|
Quantité |
Nom |
Étape |
|---|---|---|
|
1 |
Plaque chauffante |
P1 |
|
1 |
Four |
P5 |
|
1 |
Casserole |
P1 |
|
1 |
Thermomètre |
P1 |
|
1 |
Récipient pouvant aller au four |
P4 |
|
1 |
Paire de gants |
P4 |
|
1 |
Linge propre |
P2 |
|
1 |
Saladier ou un grand récipient |
P2 |
|
1 |
Tablier |
P1 |
|
1,5 c. à s. |
Borax |
P3 |
|
500 g |
Fromage blanc 0% MG |
P1 |
|
1,5 c. à s. |
Colorant (facultatif) |
P4 |
|
1 500 kg |
Huile de coude |
P2 |
Manipulations, procédés, marche à suivre
P1 : Chauffer le fromage blanc jusqu'à 40/50°C
Introduire 500g de fromage blanc 0% de matière grasse dans une casserole et mettre le tout à chauffer, peu de temps car la température ne doit pas dépasser les 50°C. Nous ne voulons pas cuire le lait, mais simplement le chauffer.


Pendant ce temps de chauffe du lait, préparer la suite des interventions :

P2 : Filtrer à chaud à travers un linge propre, presser jusqu'à épuisement.
Préparer un saladier, ou un grand récipient avec un linge épais à l'intérieur (chiffon ou une serviette épaisse par exemple). Verser alors le fromage blanc encore chaud dans le creux du tissu, puis épuiser le tout (sans vous brûler bien évidement, car le fromage blanc sera encore chaud).


P3 : Récupération des protéines, ajouter 1,5 cuillère à soupe de borax.
Sortez l'huile de coude et enfilez vos gants, nous allons pétrir. Prenons les résidus pâteux que nous avons à l'intérieur du chiffon après épuisement, malaxons le avec 1,5 cuillère à soupe de Borax (pour 500g, après vous pouvez toujours ré-adapter toutes ces quantités) et ajoutons le colorant au même moment si on souhaite lui donner un aspect particulier.


P4 : Laisser reposer au four, aéré, chaleur tournante. 80°C.
Nous voici presque au bout de notre peine (mais pas encore au bout de notre tutoriel  vous allez encore devoir supporter quelques lignes !) il suffit de racler le chiffon pour mettre notre mélange caséine/borax, qui commence à durcir, dans un récipient résistant à la chaleur. Le principe ici est de faire comme dans une étuve : éliminer l'eau, pas cuire un gâteau, juste déshydrater et aérer.
vous allez encore devoir supporter quelques lignes !) il suffit de racler le chiffon pour mettre notre mélange caséine/borax, qui commence à durcir, dans un récipient résistant à la chaleur. Le principe ici est de faire comme dans une étuve : éliminer l'eau, pas cuire un gâteau, juste déshydrater et aérer.



Nous avons laissé la porte du four ouverte, pour que la chaleur tournante évacue l'air humide au fur et à mesure
Observations lors des manipulations
P1 : Chauffer le fromage blanc jusqu'à 40/50°C
Un thermostat 5, durant 2 minutes (plaques à induction) nous a suffit à chauffer le fromage blanc. Nous avons constaté que la protéine coagule facilement sous l'effet de la chaleur.
P2 : Filtrer à chaud à travers un linge propre, presser jusqu'à épuisement.
Au début, un liquide transparent/blanc cassé va sortir, mais le point culminant de cette opération est de réussir à presser assez fort pour qu'un coulis visqueux blanc en sorte. Les images parlent d'elles mêmes. Le résidu contenu dans le linge contient les protéines du fromage blanc, elles doivent prendre la forme du tissage du linge pour montrer qu'elles sont bien compactes et déshydratées. La texture est une pâte granulée.
P3 : Récupération des protéines, ajouter 1,5 cuillères à soupe de Borax.
Faire cette opération dans le linge (posé sur une assiette) est plus pratique. Nous avons nos résidus encore humides étalés alors sur le linge, nous saupoudrons le borax et le colorant pour ne pas faire d'agglomérat inutilement. Lorsque l'on pétri, on peut sentir la pâte durcir légèrement, on peut mettre plus de borax, jusqu'à 3 cuillères sans que ça ne soit gâché.
P4 : Laisser reposer au four, aéré, chaleur tournante. 80°C.
Ici lors de la mise en boîte, il faut faire attention à tapoter le récipient contenant la galalithe, nous ne devons avoir aucune bulle d'air piégée pour que notre bloc de plastique puisse être travaillé à la fin. Il est important d'obtenir des surfaces planes. Nous ne laissons la porte ouverte qu'un certain temps, car à partir de 500g il est nécessaire d’élever la température et d'avoir un bon séchage. Pour 250g de Fromage blanc de départ, on peut choisir 3 heures tranquillement à 80°C, à la suite de quoi vous obtiendrez une flaque jaune/transparente (si sans colorant) qu'il faudra faire sécher plusieurs jours (3) à l’abri de la poussière.
Attention risque que la plaque gondole.
Voici donc les résultats tant attendus :


Voilà pour les conseils concernant les manipulations, mais notre épopée n'est pas encore finie. Il vous suffit d'être patient, d'attendre la suite de ce mini-tutoriel. Une annexe traitera des améliorations possibles applicable à ce protocole, et quelques réponses aux constatations récurrentes au sujet de la caséine.
Merci pour votre lecture en espérant que cela vous ai plu.
Je tenais, dans cette partie, à remercier PtiLuky pour sa révision spontanée de l'orthographe. En effet PtiLuky m'a proposé son aide instantanément, au moment où le site voyait à peine le jour. Cela fait chaud au cœur qu'une communauté naissante, soit déjà réellement une communauté !
Un remerciement à pierre_24 pour ses idées de vulgarisation toujours si parlantes !
Je remercie aussi tout particulièrement l'aide de GriffeDeKoala pour son investissement à mes cotés pour la relecture orthographique et syntaxique, ainsi qu'une relecture minutieuse des éléments pédagogiques de ce tutoriel. Son excellent boulot en tant que photographe des manipulations et son aide en tant que commis lors des essais.
J'espère que vous saurez apprécier le cœur mis à l'ouvrage durant cette lecture et que vous en sortirez avec le sourire.





 !
! 

