Parlons d’Ytterby. Cette petite bourgade au Nord de Stockholm, en Suède, peut être atteinte en prenant la ligne de métro rouge jusqu’à l’institut royal de technologie, puis le bus 670, en descendant un peu avant le très touristique Vaxholm. Pas grand-chose à y voir : pas de forteresse, pas de liaison maritime vers les îles de l’archipel, telle Grinda, si agréable durant l’été, ni de logements étudiants. En soi, peu de raisons d’aller y faire un tour.
Pourquoi est-ce que je vous parle de cette ville dans ce cas ? Pour une raison toute simple. Sa mine. Une mine de fer, creusée au XVIIe siècle. Et fermée de nos jours, depuis 1933. OK, on dirait vraiment que je ne fais pas d’efforts particulier pour vous inciter à lire l’article… Mais peut-être que cette mine a eu un impact historique. Voyons voir, XVIIe siècle, la Suède crée son Empire, prends des territoires russes, une grosse partie de la Finlande actuelle, un peu de la Norvège, un peu des pays baltes. Ça va être un article d’histoire ? Heureusement pour vous, je ne me risquerai pas à écrire quoi que ce soit sur l’histoire, ça demanderait des connaissances que je n’ai pas.
Du coup, est-ce qu’on pourrait arrêter de tourner autour du pot, en enfin révéler le pourquoi de cet article ? Très bien, vous vous rappelez du nom de la ville ? Ytterby, qu’on pourrait traduire en « village périphérique » ou « village excentré ». Le nom ne vous dit rien ? Et si je vous dis yttrium, terbium, erbium et ytterbium ? Oui en effet, quatre éléments nommés d’après cet endroit. C’est de ça dont on va parler, de cette mine de fer où on a découvert neuf éléments, les cinq autres n’ayant pas hérité leur nom de ce village.
Cet article est une introduction. Il n’y a pas besoin d’avoir un bagage scientifique, et les concepts abordés sont introduits.
- Quels éléments y ont été identifiés ?
- Un tout petit peu d'histoire
- Comment les a-t-on identifiés ?
- Découverte de nouveaux éléments de nos jours
Quels éléments y ont été identifiés ?
Comme je vous l’ai dit, on a identifié 9 éléments provenant des matériaux extraits de cette mine. Ils sont entourés en rouge sur la classification périodique un peu plus basse. À ce point de l’article, il est temps de définir ce que sont ces éléments dont je parle depuis le début.
Comme vous pouvez le lire dans le tutoriel de Gabbro sur les noyaux et la radioactivité, un atome est composé de neutrons, protons et électrons. Si deux atomes ont le même nombre de protons, alors, ils sont du même élément. Chacun de ces éléments a des propriétés chimiques et physiques bien précises. C’est grâce à ces propriétés que l’on identifiait les éléments quand on les a découverts bien avant que l’existence des protons et neutrons ne soit postulée. Du coup, on disait d’une substance que c’était un élément chimique si elle ne pouvait pas être transformée en un autre élément chimique par des réactions chimiques. Cette définition a perduré jusqu’au début des années 1910, quand la différenciation entre éléments a commencé à être faite sur le nombre de protons du noyau.

Un tout petit peu d'histoire
Oui, je vous ai menti en disant que je ne vous parlerais pas d’histoire. Mais on va garder ça trèèès court, et essayer d’expliquer rapidement le contexte qui a amené à la découverte de tant d’éléments. Toutes les informations qui suivent viennent du rapport « Ytterby gruva, Kultur- och industrihistorisk dokumentation », écrit par Lena Knutson Udd et Tommy Leek en 2012.
Donc, comme je vous disais, à la base, c’était une mine de fer, dont la production vraisemblablement démarra au XVIIe siècle, même si la première trace écrite date de 1756, quand un échantillon fut envoyé à un laboratoire pour une analyse. Le quartz y était extrait, et envoyé dans le nord de la Suède pour récupérer le fer qui y était contenu. Au milieu du XVIIIe siècle, le quartz était aussi utilisé à Stockholm pour en faire du verre. Rapidement, aux alentours de 1790, le feldspath fut également extrait, pour en faire de la porcelaine.
En 1787, Carl Axel Arrhenius y découvrit une roche noire, inconnue jusqu’à présent. C’est ce qui presque 230 ans plus tard motiva l’écriture de cet article, et les évènements qui suivirent sont détaillés dans la section suivante.
Après avoir été fermée en 1933, la mine fut de nouveau utilisée à la fin des années 1940, pour y entreposer des produits pétroliers. Le stockage du kérosène s’arrêta en 1978, quand du sulfure créé par des micro-organismes y fut découvert. Du diesel y fut ensuite entreposé jusqu’en 1995, quand la mine fut définitivement vidée. Le décomissionement du site, entrepris en 1997, se termina en 2006.
Différents scénarios sont maintenant considérés (ou tout du moins l’étaient en 2012), allant de la création d’un musée à la disparition de toute trace en surface de la mine, après l’avoir remplie.
Dans le même temps, après avoir réalisé la richesse de ses gisements de fer et de cuivre, la Suède décida de développer ses compétences en chimie et en métallurgie. Le développement de la chimie fut rapide au XVIIIe siècle, poussé par l’industrie minière. Le laboratoire « Chymicum » fut fondé, l’université d’Uppsala appointa son premier professeur de chimie, faisant ainsi de la Suède le moteur de la chimie pendant les trois dernières décennies du XVIIIe siècle.
Comment les a-t-on identifiés ?
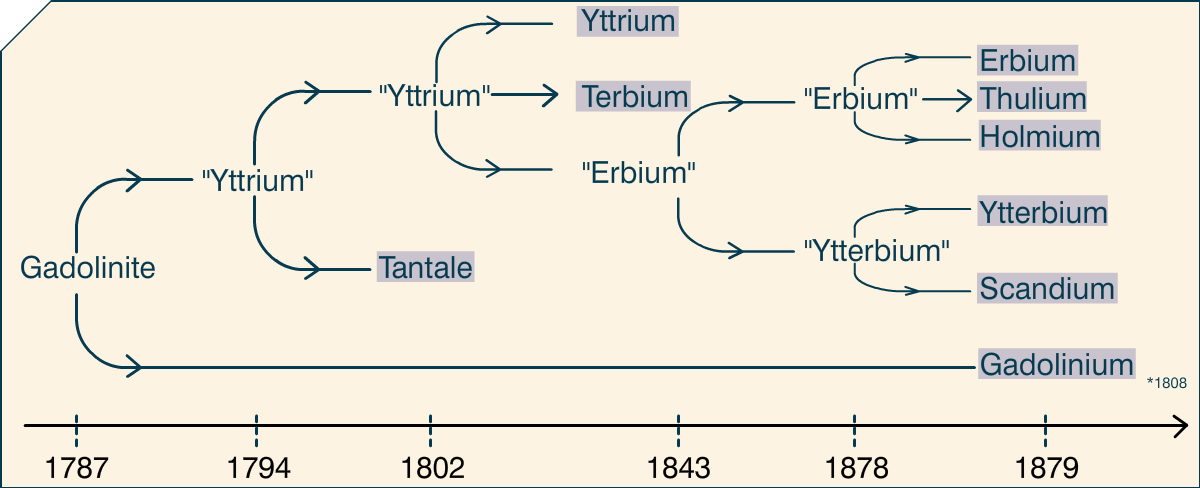
C’est dans le contexte défini juste au-dessus que Carl Axel Arrhenius découvrit une roche noire au milieu des feldspaths blancs de la mine en 1787. Pensant que cette roche pouvait contenir du tungstène, récemment découvert, il décida de l’emporter pour l’analyser, avec l’aide de Geijer et Rinman. Johan Godalin, un chimiste finlandais travaillant en Suède analysa bien plus en détail cette roche et publia ses conclusions en 1794 (bien que la découverte en elle-même date de quelques années plus tôt). Dedans, il trouva un élément qu’il appela « ytterjord » (terre de la surface, peu ou prou), avant que le nom yttrium ne soit adopté, d’après la ville de la mine. La roche elle-même pris le nom de gadolinite.
Ekeberg confirma la découverte de Gadolin, et en 1802 ajouta un nouvel élément, le tantale. Passe ensuite une longue période, jusqu’à ce que l’élève d’Ekeberg, Berzelius, ait un élève, Mosander, qui analysa l’yttrium de Gadolin, et découvrit en 1843 qu’il y avait en fait trois éléments dans ce matériau. L’un garda le nom d’yttrium, et les deux autres furent appelés erbium et terbium.
Plus tard, en 1878, Jean-Charles Galissard de Marignac étudia l’erbium de Mosander, et remarqua qu’il n’était pas homogène, mais composé de deux éléments : l’erbium et l’ytterbium. L’année suivante, une analyse plus poussée de l’erbium par Per Teodor Cleve montra qu’il y avait aussi du Thulium (d’après Thulia, « le nord extrême ») et du holmium (d’après Stockholm). En parallèle, la même année, Lars Fredrick Nilson analysa l’ytterbium et y découvrit du scandium (d’après la Scandinavie). Galissard de Marignic identifia le gadolinium en étudiant de la gadolinite en 1880.
Pour résumer, une roche étrange fut découverte. Dedans, 35-50% de sa composition était inconnue. En faisant des analyses de plus en plus fines, neuf éléments y furent découverts. Reste à savoir comment.
Plusieurs techniques ont été utilisées pour ces éléments. Après l’invention du spectroscope en 1859, la plupart des découvertes, telles celle du gadolinium, se sont basées sur l’étude des lignes spectroscopiques (Separation of Rare Earth Elements, Charles James). Avant, la séparation se faisait principalement par des méthodes chimiques, en utilisant des cristallisations partielles (Biochemistry of the Lanthanides, Christopher H. Evans). Puisque les lanthanides (la plupart des éléments mentionnés précédemment, sur la même ligne dans la classification périodique) ont des propriétés chimiques très proches, les isoler est compliqué, ce qui explique que le travail a dû être refait plusieurs fois, avec de nouvelles découvertes au fil du temps.
Analyse spectrale et identification d’un élément
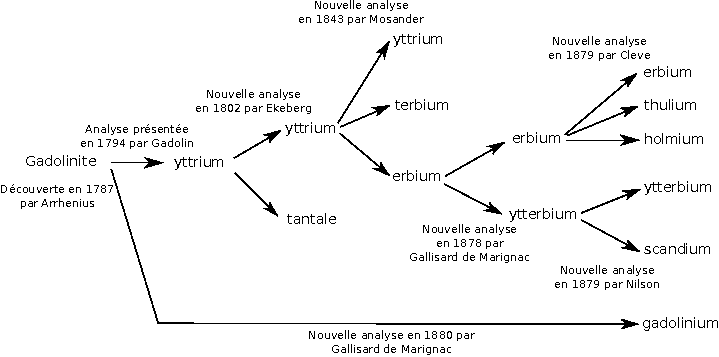
Tout élément chimique a un spectre d’émission qui lui est caractéristique, et qui peut être utilisé pour l’identifier. D’accord, mais c’est quoi un spectre d’émission ? Quand un atome excité se désexcite, il émet des particules gamma. L’énergie de ces particules ne peut prendre que certaines valeurs, comme l’a démontré la mécanique quantique (nous n’irons malheureusement pas dans les détails dans cet article). En analysant les différentes énergies mesurées, on peut dire à quel élément on a à faire.
À chaque énergie correspond une longueur d’onde, reliée à l’énergie par la relation $E=\frac{hc}{\lambda}$, où h est la constante de Planck. Certaines longueurs d’onde sont visibles par l’œil humain, et une manière de représenter les spectres d’émission est donc basée sur la couleur. Ci-dessous, les spectres d’émission de quelques éléments sont représentés. Comme vous le voyez, ils sont bien tous différents les uns des autres. L’axe des abscisses, en nanomètres, représente la longueur d’onde.
Pour obtenir ces spectres, il suffit donc de bombarder un échantillon avec des photons pour en exciter ses atomes. Ça peut être fait simplement en utilisant un laser.
Découverte de nouveaux éléments de nos jours
En janvier dernier, la découverte des éléments jusqu’à 118 protons à été confirmée. L’élément le plus lourd formellement découvert est donc l’ununoctium (Uuo). Ce nom est temporaire, est sera changé quand l’IUPAC (International Union of Pure and Applied Chemistry) aura décidé de la nouvelle dénomination. D’après leurs recommandations, ce nom devra être issu d’un concept mythologique, d’un minéral, d’un lieu ou d’un scientifique.
Revenons-en à nos moutons. Comment découvre-t-on de nouveaux éléments de nos jours ? La réponse à cette question comprend deux grandes parties :
Comment les fabriquons-nous ?
En effet, tous les éléments présents naturellement sur Terre ont été identifiés, et il n’y a plus de trou dans la classification périodique. Du coup, tout nouvel élément découvert sera synthétique : c’est-à-dire qu’il résultera d’une action humaine.
La manière actuelle de faire est simplement d’organiser une collision entre deux atomes plus légers, de telle manière à ce qu’une fusion se produise. Par exemple,
L’un des problèmes est que les noyaux lourds ont beaucoup plus de neutrons que de protons, et qu’en en fusionnant deux plus légers, on n’aura pas assez de neutrons pour stabiliser le noyau cible. C’est pour cela qu’un noyau lourd est déjà utilisé, pour avoir ce déséquilibre dès le début. Dans l’exemple, c’était du californium. Pour créer l’élément 117, du berkélium (97 protons !) a été utilisé.
Est-ce pour autant suffisant pour créer ces nouveaux éléments ? Et bien oui, mais pas vraiment. Reprenons l’exemple de l’élément 117. En plus du berkélium, 10 milliards de milliards d’atomes de calcium ont été utilisés. Et pour quel résultat ? Quatre malheureux atomes de ce nouvel élément.
Et pour ajouter l’insulte à l’injure, la durée de demi-vie de ces noyaux, avant qu’ils ne fissionnent, est d’environ 80 millisecondes. Reprenons : durée de vie courte, et très peu d’atomes formés. C’est tout ? On pourrait aussi ajouter la très forte radioactivité et le fait que le faisceau de particules incidentes ait une intensité très élevée. Bon courage pour les détecter…
Comment les détectons-nous ?
Bon, donc, comment fait-on ? Il va falloir un système qui accomplisse plusieurs missions : séparer les éléments super-lourds des autres, séparer les éléments super-lourds entre eux, selon leur masse et leur charge, mesurer leur énergie cinétique, etc.
Commençons par un schéma d’un détecteur classique. Il y a bien sûr des variations, mais le but ici est juste de comprendre les principes derrière ces détecteurs plutôt que d’en faire une liste exhaustive. Ici, on va se concentrer sur le Vassilissa 2000, utilisé au Flerov Laboratory of Nuclear Reactions, en Russie, et représenté ci-dessous.
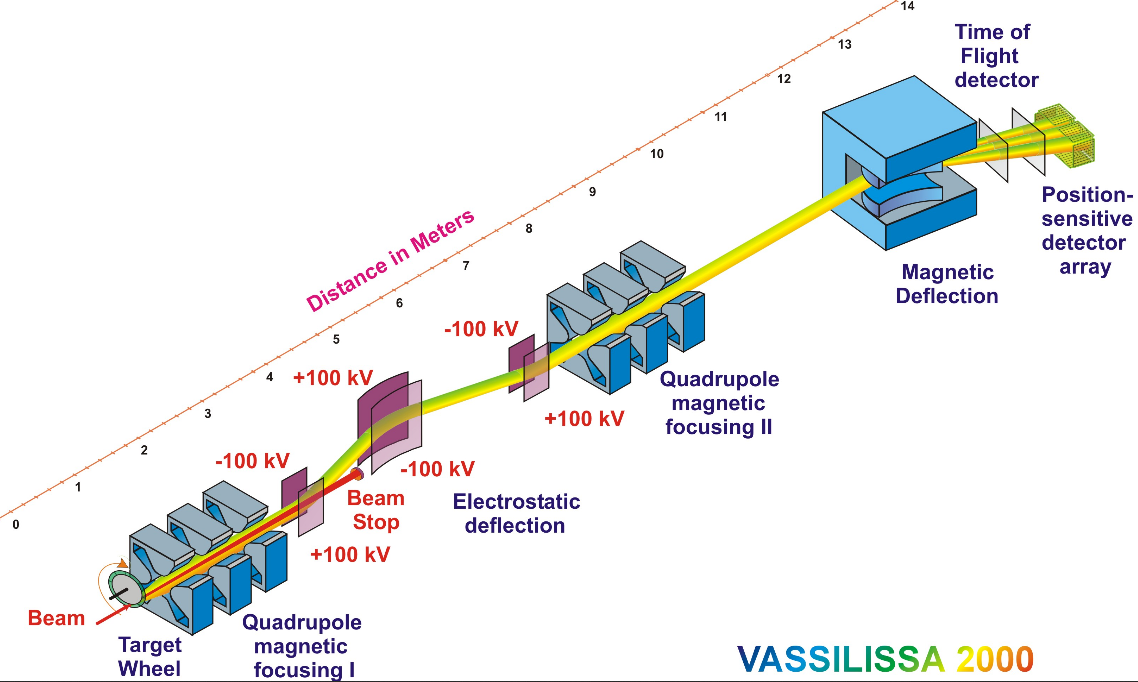
Prenons les éléments de ce système dans l’ordre.
D’abord, le faisceau de particules stables rencontre la cible, composée d’éléments déjà lourds. Cette cible est positionnée sur une roue qui tourne. Ceci est fait pour pouvoir utiliser un rayon incident plus intense sans faire fondre localement la cible. Souvent, cette cible est aussi placée dans une chambre remplie de gaz à très faible pression. L’idée ici est d’homogénéiser la charge de tous les atomes super-lourds créés (et donc leur nombre d’électrons, puisque le nombre de protons est ce que l’on veut observer), afin de faciliter la détection par la suite.
Les éléments super-lourds sont ensuite créés, mais leur direction de recul n’est pas identique entre-eux. Les quadrupôles magnétiques sont utilisés pour les focaliser. À ce point, puisque la moyenne des directions des éléments super-lourds est la même que celle du rayon incident, ils sont focalisés dans la même direction, et il faut donc les séparer. C’est ce qui est fait un utilisant des champs électromagnétiques, qui dévient les particules de manière différente selon leur charge.
Faisons une petite pause pour voir comment les champs électriques et magnétiques peuvent séparer les atomes. La force sur une particule de charge q et de masse m dans un champ électrique est $\vec{F}=q\vec{E}$ et dans un champ magnétique, $\vec{F}=q\vec{v}\times\vec{B}$. En combinant ces champs, il est possible de séparer les atomes selon leur charge et leur masse, puisque leur trajectoire est déterminée par l’équation $\Sigma \vec{F}=m\vec{a}$.
Les derniers éléments de ce système ont pour but de donner des informations sur les atomes super-lourds créés. Le champ magnétique va les séparer selon leur masse et leur charge, et les détecteurs mesurant la durée de vol va nous informer sur leur énergie cinétique.
À part la première étape, pour laquelle on souhaite réaliser la détection dans un gaz à faible pression, tout le reste est fait dans le vide, pour éviter de parasiter les résultats.
On peut aussi mentionner que ce type de détecteur (« recoil separator ») est typiquement utilisé si l’énergie des projectiles est relativement faible (inférieure à 10 eV/u pour les connaisseurs), mais le principe reste le même pour les faisceaux plus énergétiques : séparer les nouveaux atomes du faisceau incident et obtenir des informations sur ces nouveaux atomes.
Et c’est tout ! Pour résumer, vous connaissez maintenant la mine d’Ytterby, où 9 éléments ont été découverts. La chronologie et la manière dont ils ont été découverts forment la première partie de l’article. Ensuite, on a vu rapidement comment les éléments étaient créés et isolés de nos jours.
Pour aller plus loin, les domaines de la spectrographie et de l’électromagnétisme, abordés ici, sont vastes et intéressants. Pour la découverte des éléments super-lourds en elle-même, il faudrait apprendre un peu de mécanique quantique, qui peut donner des indices sur comment les former, et sur lesquels seront suffisamment stables pour être détectés.
Il est grand temps d’ouvrir une mine ici et de découvrir le zestium !