- « Les réseaux de zéro » : le livre sort en librairie le 17 février
- Comment adhérer à l'Union Européenne ?
M. X a un peu plus de 60 ans. Il y a quelques années, il a eu un adénocarcinome colique, il s’agit d’une tumeur du côlon. En un mot : un cancer.
Pour guérir ce cancer, outre la chimiothérapie et l’éventuelle radiothérapie, le traitement repose avant tout sur la chirurgie : on enlève la partie du côlon dans laquelle s’est développée la tumeur, partie qui peut être plus ou moins longue suivant le stade d’avancement du cancer. Cette opération est une colectomie1.
L’opération de M. X s’est très bien passée, il a pu rentrer chez lui et reprendre sa vie. Quelques années plus tard, M. X se présente de nouveau aux urgences pour constipation et douleurs à l’abdomen. Parfaitement banal, non ? Il y a fort à parier que ça vous soit déjà arrivé et qu’on vous ait dit de manger des fibres voire de prendre un laxatif. Seulement, M. X a déjà été opéré du tube digestif et ce simple fait rend sa constipation beaucoup moins banale puisqu’il est à risque d’une complication fréquente de la chirurgie viscérale qui s’appelle l’occlusion sur bride.
Et pour M. X, c’est le début des ennuis.
Dans cet article, je vous propose une étude de cas qui me permettra de vous montrer comment on prend en charge un patient atteint d’une pathologie complexe, comment on raisonne devant les symptômes pour trouver un diagnostic et comment on gère les complications.
- Les opérations chirurgicales qui finissent par -ectomie sont des ablations de l’organe qui compose la première partie du mot. Une appendicectomie est une ablation de l’appendice, une mammectomie une ablation de la glande mammaire et une colectomie, une ablation du côlon (en partie tout du moins, on enlève rarement tout).↩
- Adénoquoi ?
- Vous reprendrez bien un peu de bistouri ?
- Avez-vous la carte de fidélité ?
- Suites et fin
Adénoquoi ?
L’appareil digestif en bref
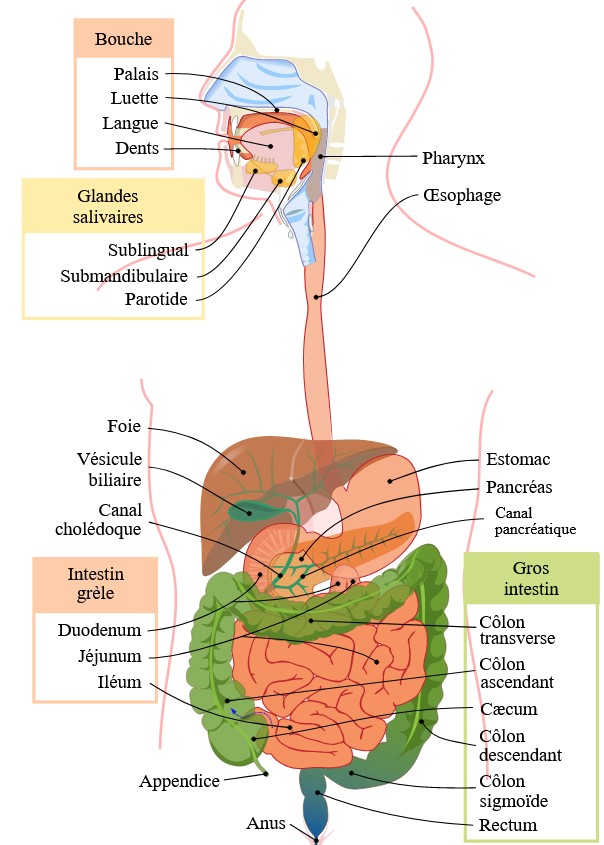
L’anatomie du système digestif est généralement bien connue mais ça ne coûte rien de faire un petit rappel. Le bol alimentaire (ou bolus, c’est comme ça qu’on désigne ce qu’on consomme par voie orale) entre par la bouche puis traverse l’œsophage pour arriver dans l’estomac afin d’être digéré.
Après l’estomac, ce sont les intestins qui prennent le relai : tout d’abord l’intestin grêle (constitué de trois parties détaillées sur le schéma) long d’environ 6 mètres (même si ça peut varier beaucoup d’une personne à une autre) et qui forme des anses au centre de l’abdomen. Puis l’intestin grêle laisse place au côlon ou gros intestin, leur jonction se fait au niveau du cæcum (en bas à gauche du schéma), juste au-dessus de l’appendice.
Le côlon est en plusieurs parties :
- une partie droite ou côlon ascendant,
- une partie médiane ou côlon transverse,
- une partie gauche ou côlon descendant,
- une partie finale qui ramène le tube digestif au centre de l’abdomen, le côlon sigmoïde.
Le côlon entoure ainsi l’intestin grêle, formant ce qu’on appelle le cadre colique. Le côlon sigmoïde donne ensuite le rectum puis l’anus.
À côté du tube digestif, il existe d’autres organes comme le foie ou le pancréas qui sont chargés de produire des liquides qui permettent la digestion (la bile). Bien entendu, ces organes ont aussi de nombreux autres rôles mais qui n’ont pas une grande importance pour la suite du propos.
Carcinogenèse
Dans la paroi du côlon, se situent des glandes de Lieberkühn qui sont chargées de synthétiser une partie des enzymes de la digestion. Certaines mutations génétiques (souvent héréditaires ou parfois acquises avec l’âge) vont pousser les cellules qui constituent ces glandes à proliférer plus que nécessaire et à former des petites masses bénignes à l’intérieur de la lumière du côlon que l’on appelle des polypes.
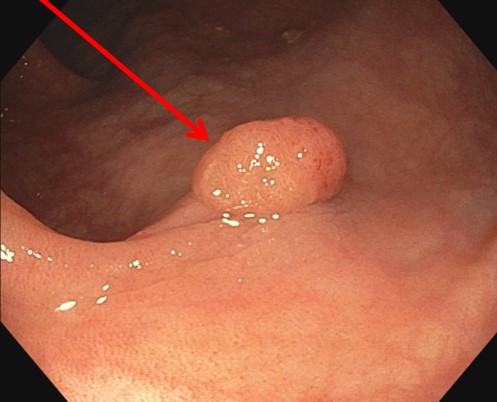
Certains polypes considérés comme à risque (de par leur taille, leur forme et leur nature cellulaire) vont évoluer sur 10 à 20 ans pour devenir des adénocarcinomes, des tumeurs cancéreuses. À partir de là, le cancer va se mettre à proliférer, mais sur un rythme beaucoup plus rapide. En quelques mois seulement, les cellules vont infiltrer la muqueuse colique puis diffuser dans le système lymphatique pour atteindre et envahir les ganglions. Puis le cancer va diffuser dans tout l’organisme et atteindre les autres organes (particulièrement le foie) formant des métastases.
Le pourcentage de survie à un cancer colo-rectal dépend essentiellement de son stade d’avancement, mais il n’est pas très bon. C’est également un type de cancer qui récidive beaucoup. Au stade métastatique, c’est la chirurgie qui décide du pronostic : si les métastases ne sont pas résécables, le cancer est généralement fatal en moins de deux ans.
Pour toutes ces raisons et parce que l’âge est le principal facteur de risque, un dépistage de masse est organisé à partir de 50 ans dans la population générale et qui consiste à envoyer un échantillon de selles à un laboratoire tous les deux ans afin d’y rechercher des traces de saignements (les tumeurs colo-rectales étant fréquemment associées à des saignements).
Le traitement par chirurgie
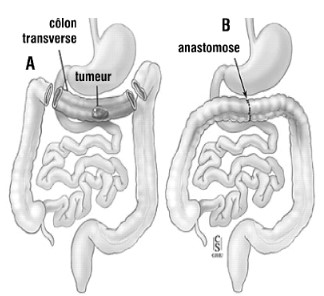
La chirurgie digestive est le pilier du traitement du cancer colo-rectal. On enlève la partie de l’intestin atteinte puis on fait ce qu’on appelle une anastomose.
La première étape c’est logiquement d’ouvrir l’abdomen pour accéder aux organes situés à l’intérieur. Pour ce faire, on choisit généralement l’un des deux abords les plus classiques :
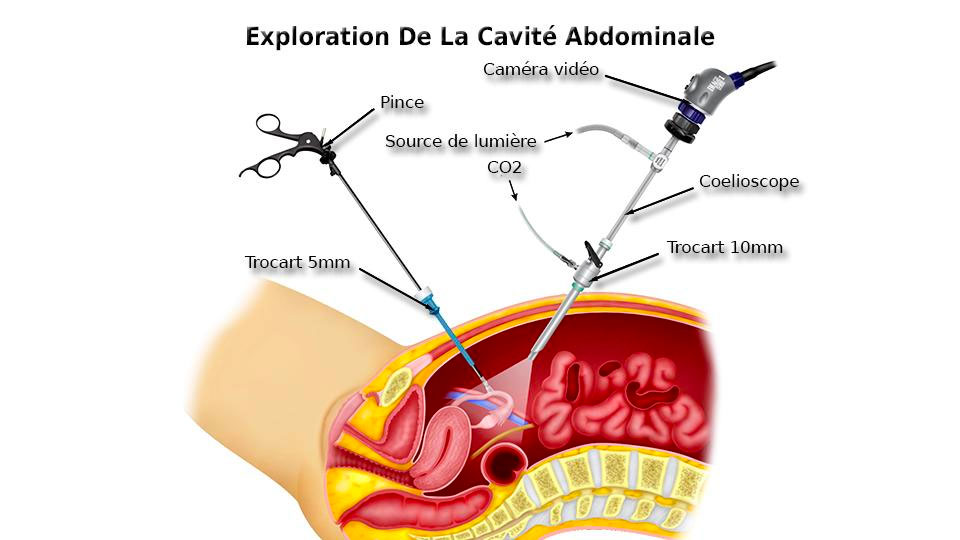
- la cœlioscopie (ou laparoscopie), une technique où l’on pratique plusieurs petites incisions par lesquelles vont passer les instruments utilisés, le premier d’entre eux étant une caméra qui permet au chirurgien de voir l’intérieur de l’abdomen.
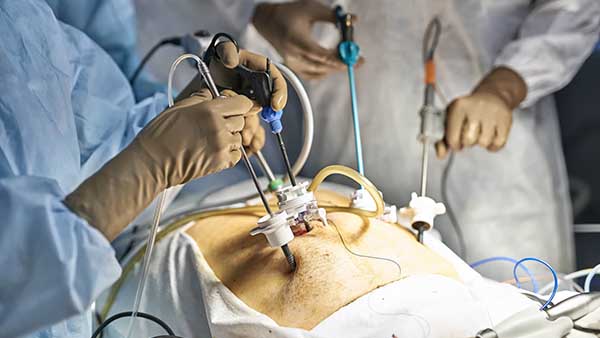
Les tubes en plastique plantés dans la peau par lesquels passent les instruments sont appelés des trocarts. Dans le fond de l’image, un peu flou, masqué par la main gauche du chirurgien en bleu, vous pouvez voir un appareil relié à un épais câble blanc et un câble plus fin, gris, et dont l’autre extrémité est métallique et rentre dans l’abdomen. Il s’agit de la caméra, généralement appelée optique.
- la laparotomie, plus classique, dans laquelle le chirurgien fait une grande incision et manipule le tube digestif par le biais de cette ouverture.
Le choix de la voix d’abord est fait par le chirurgien et repose sur de nombreux critères. La cœlioscopie est favorisée quand elle possible parce que les incisions sont moins grandes et donc moins traumatiques pour le patient. Quand elle n’est pas possible, on opte pour une laparotomie. Il arrive par ailleurs que le chirurgien se rende compte pendant l’opération que la cœlioscopie ne fonctionne pas et décide d’ouvrir l’abdomen. On dit alors que l’opération est laparo-convertie.
Une fois l’abord effectué et avant de couper le côlon, il est nécessaire de le libérer. En effet, le tube digestif est relié à la paroi de l’abdomen et à d’autres organes par tout un tas de structures fibreuses qu’il faut couper pour pouvoir le manipuler sans abîmer ce qu’il y a autour. Pendant cette opération, il n’est pas rare de provoquer de petits saignements car il y a des vaisseaux sanguins partout. Dans ce cas-là, le chirurgien fait l’hémostase, c’est-à-dire qu’il arrête les saignements. Ça se fait généralement grâce à des instruments qui font circuler un petit courant électrique local dans la zone concernée, la brûlant légèrement.
La résection colique se fait grâce à un instrument qui s’appelle l’endo gia.

C’est un appareil qui coupe un organe et agrafe les moignons de chaque côté, parfait pour du tube digestif. La partie réséquée est appelée pièce opératoire. Elle est extraite et envoyée en service d’anapath (de son nom complet : anatomie et cytologie pathologique, à vos souhaits ) afin d’être analysée.
Finalement, le chirurgien procède à l'anastomose. Il s’agit de rétablir la continuité entre les deux moignons du tube digestif (celui avant la zone enlevée et celui après). Pour cela, il va pratiquer une petite incision dans chacun des deux moignons et relier les deux trous entre eux par le biais d’un fil de suture. Seulement, la zone de l’anastomose est fragile et il est souvent nécessaire de la laisser au repos pour qu’elle puisse cicatriser tranquillement. Dans ce cas, on va mettre en place une stomie en amont. Globalement, il s’agit de faire une ouverture dans la peau et le tube digestif pour que les selles s’évacuent dans une poche prévue à cet effet plutôt que de continuer dans les intestins et passer par la zone fragile.
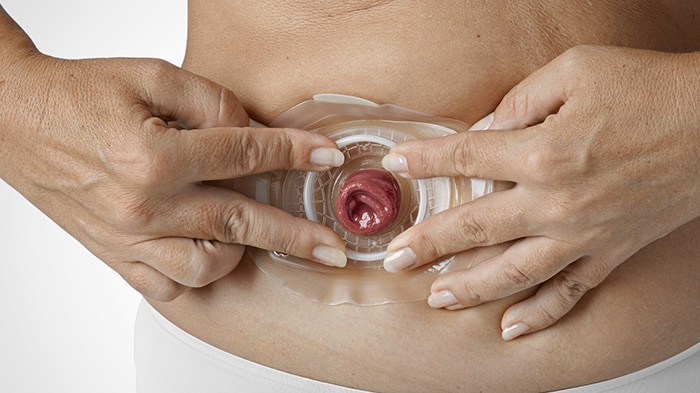
On voit bien l’intestin (en rose) qui passe à travers la peau. On fixe au dispositif une poche qui servira de recueil. Ce type de stomie s’appelle une stomie de protection car son but est de protéger le côlon en aval.
Vous reprendrez bien un peu de bistouri ?
C’est bouché !
Petite ellipse de quelques années : M. X se présente aux urgences pour constipation (appelée arrêt des matières et des gaz) associée à des douleurs digestives, des vomissements et une distension de l’abdomen : un syndrome occlusif dans le jargon médical.
La constipation est un symptôme tellement fréquent que, quand les patients viennent aux urgences, c’est soit que ça dure depuis plusieurs jours soit que la douleur est intense. Il convient donc de prendre les plaintes très au sérieux d’autant qu’elles peuvent relever d’une urgence chirurgicale.
Il existe deux grands types d’occlusion :
- les occlusions mécaniques, un obstacle gêne le transit. Ça peut être quelque chose qui bloque à l’intérieur de la lumière (une tumeur par exemple) ou un organe adjacent qui comprime l’intestin.
- les occlusions fonctionnelles, il n’y a aucun obstacle qui gêne le transit, mais les muscles chargés de propulser le bol alimentaire s’arrêtent de fonctionner et l’intestin passe au repos forcé.
Pour faire la différence entre les deux, on réalise un scanner :
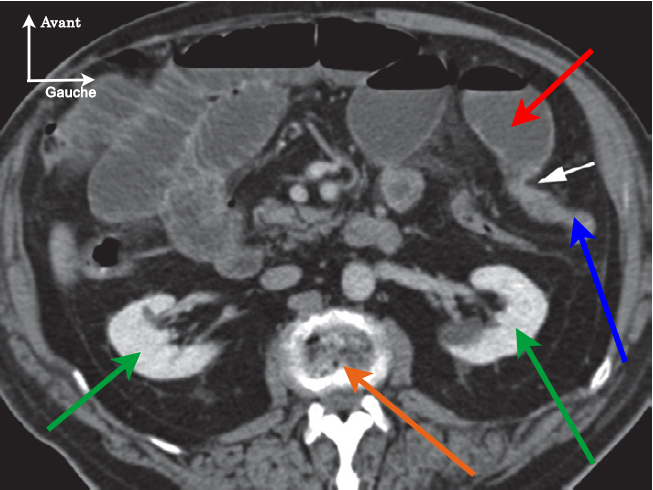
Ce n’est pas évident à lire, donc on va essayer de décortiquer ça ensemble. La première chose qu’il faut comprendre c’est qu’un scanner fait des coupes transversales, c’est-à-dire dans la profondeur. Ce que vous voyez en haut de l’image c’est donc l’avant du corps (l’abdomen) et ce que vous voyez en bas, c’est l’arrière (le dos). Le scanner inverse également la gauche et la droite, donc à gauche de l’image nous avons la partie droite du corps et inversement. C’est ce qui est indiqué en légende.
Le scanner nous donne donc une image horizontale. Pour se repérer en hauteur, on utilise généralement le niveau de la vertèbre visible. Ici, il s’agit de la structure pointée par la flèche orange et c’est la vertèbre L2, la 2e vertèbre lombaire.
Pointés par les flèches vertes, vous pouvez voir les reins, le rein gauche à droite et le rein droit à gauche. Ils permettent de savoir que nous sommes en L2 puisqu’il n’y a qu’à ce niveau qu’on voit les deux aussi bien.
Intéressons-nous maintenant aux flèches rouge et bleue. Elles pointent toutes les deux l’intestin grêle, mais il y a une différence de taille :
- le grêle au niveau de la flèche rouge est énorme, on dit qu’il est dilaté,
- a contrario, le grêle au niveau de la flèche bleue est tout petit, on dit qu’il est plat.
L’obstruction se situe au niveau de la flèche blanche, que l’on appelle la jonction grêle plat-grêle dilaté. Le grêle dilaté est en amont : le contenu du tube digestif ne passe plus donc il s’accumule et distend l’intestin. Le grêle plat est en aval : le contenu digestif avance mais comme ce qui suit est bloqué, l’intestin se retrouve complètement vide et s’aplatit.
Cette image de transition brutale entre une zone dilatée et une zone plate sans signe de torsion (une autre cause d’occlusion) signe ce que l’on appelle une occlusion sur bride.
Les brides peuvent se former spontanément, mais c’est assez rare : les brides les plus fréquentes sont post-opératoires. L’intestin est entouré par une membrane, le péritoine. Cette membrane n’est pas qu’un moyen de fixer les organes entre eux, c’est également une protection et le moyen de vascularisation de l’appareil digestif. En libérant les intestins pour y avoir accès pendant l’opération, on sectionne le péritoine qui réagit en sécrétant des protéines de cicatrisation. Ces protéines vont accoler les organes entre eux pour permettre aux agents anti-inflammatoires d’agir plus efficacement. Une fois le processus terminé, un mécanisme de fibrinolyse permet le relâchement de ces accolements.
Parfois cependant, les protéines s’emballent et forment des accolements en forme de bande ou de cordelette entre deux organes : des brides. Les brides étant relativement solides, la fibrinolyse est parfois incapable de les rompre et elles restent en place, des mois, des années voire des dizaines d’années. Elles peuvent rester (et restent le plus souvent) parfaitement asymptomatiques mais dans certains cas, à l’occasion d’un mouvement d’organe dans l’abdomen, elles vont se tendre en coudant ou en comprimant l’intestin voire le forçant à se tordre sur lui-même, bloquant le transit. Plus grave, ces mouvements peuvent également bloquer la circulation des vaisseaux sanguins qui vascularisent l’intestin, occasionnant une nécrose d’installation rapide.
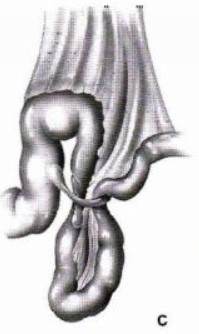
Pour toutes ces raisons, l’occlusion intestinale sur bride est une urgence chirurgicale : il faut très rapidement opérer et sectionner les brides. Si le chirurgien constate des signes de souffrance de l’intestin, il peut également être amené à en réséquer une partie. M. X doit donc repasser au bloc.
Débouchons
Dans les hôpitaux qui disposent d’un service d’urgence et de services de chirurgie en support, il y a un chirurgien de garde par spécialité concernée par les urgences (chirurgie abdominale et chirurgie thoracique par exemple) toutes les nuits, tous les week-ends et tous les jours fériés. Quand un patient relevant de sa spécialité se présente aux urgences, les urgentistes l’appellent pour l’examiner et c’est lui (ou plus généralement son interne) qui prend la décision d’opérer immédiatement, plus tard ou pas du tout.
Quand la décision d’opérer immédiatement est prise, il faut contacter la coordination du bloc qui se charge de préparer la salle et de prévenir le personnel nécessaire :
- un ou plusieurs infirmiers de bloc,
- un anesthésiste,
- un infirmier anesthésiste.
Le patient est reçu en urgence par l’anesthésiste qui fait le point sur les antécédents et allergies qui pourraient compliquer l’anesthésie (la Covid-19 est une source possible de complication, raison pour laquelle tous les patients opérés subissent un test de détection du SARS-Cov-2 par RT-PCR).
Le patient est alors conduit dans la salle du bloc opératoire et l’équipe d’anesthésie réalise l'induction : c’est-à-dire qu’elle l’endort. Pour cela, il est d’abord perfusé (on lui pose un cathéter dans une veine du bras ou de la main). On utilisera ensuite ce cathéter pour lui administrer un médicament qui permet de suspendre la conscience (le propofol). Puis, on lui fera passer un antidouleur (de la famille de la morphine) et un décontractant musculaire (de la famille du curare), l’ordre entre ces deux derniers médicaments est déterminé par le fait que le patient soit à jeun ou non (ce qui est rarement le cas dans les opérations en urgence). Finalement, le patient est intubé.
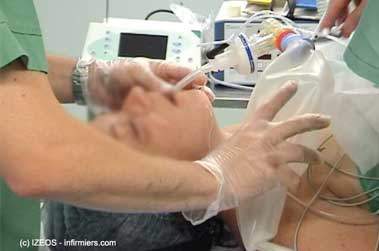
L’intubation remplace la respiration car en utilisant du curare, on empêche tous les muscles de fonctionner y compris ceux de la respiration.
Pendant ce temps, l’interne et l’externe de chirurgie s’habillent. Pour cela, ils passent un pyjama de bloc, un masque chirurgical à lanières, un calot et des sabots. Puis, dans une petite salle annexée ou bloc, ils vont très soigneusement se laver et se désinfecter les mains et les avant-bras avant d’enfiler la casaque de chirurgie ainsi que les gants stériles.
Petite vidéo qui explique comment s’habiller en stérile si ça vous intéresse.
La procédure pour enfiler les vêtements stériles est extrêmement stricte : la casaque et les gants sont pliés de manière à pouvoir les enfiler sans jamais toucher l’extérieur afin de ne pas les contaminer avec ce qui pourrait se trouver sur notre peau puisqu’ils seront amenés à être en contact avec le patient. L’arrière de la casaque est attaché par l’infirmière de bloc et une fois habillé, il convient de faire très attention. On doit garder les mains strictement entre les épaules et la taille et devant soi. On n’a plus le droit de toucher quoi que ce soit qui ne soit pas stérile, à savoir la table des instruments sur laquelle est placé un champ stérile, les instruments eux-mêmes (que l’infirmière de bloc, qui n’est pas stérile, dépose en ouvrant leur sachet au-dessus de la table, sans les toucher) et le patient après qu’il a été désinfecté.
Une fois habillés, l’interne et l’externe préparent le patient et la table. Pour le patient, il s’agit de badigeonner la zone à opérer de bétadine et d’installer des champs opératoires tout autour. Pour la table, il faut sortir et préparer les instruments, compter les compresses (pour pouvoir les recompter à la fin et être sûr de ne pas en avoir oublié dans le patient), brancher l’optique et les pinces qui ont besoin d’une alimentation.
Une fois tout cela fait, le chirurgien est arrivé et l’équipe est prête à opérer. Les membres en présence ne sont pas toujours les mêmes, mais généralement, on retrouve :
- un chirurgien
- un aide-opératoire (c’est l’interne qui tient ce rôle dans les hôpitaux publics, dans les cliniques c’est souvent un infirmier ou un étudiant en médecine de premier cycle qui fait ça comme boulot d’appoint à côté de ses études) qui tient les différentes pinces et écarteurs pendant que le chirurgien opère et qui se charge d’orienter l’optique dans les cœlioscopies,
- un infirmier instrumentiste (stérile), chargé de veiller à la bonne tenue de la table opératoire, passer les instruments au chirurgien, les nettoyer, etc. Ce rôle est souvent tenu par l’externe dans les hôpitaux universitaires.
- un infirmier circulant ou panseur (non stérile), chargé de prendre le matériel nécessaire à l’opération pendant celle-ci pour le passer à l’instrumentiste. Il s’occupe également de récupérer et étiqueter les éventuels prélèvements pour les envoyer dans les services appropriés (souvent en anapath ou en bactério). Il gère tous les imprévus dont ne peut pas s’occuper le chirurgien qui est en stérile, répond à son téléphone (un chirurgien de garde doit rester joignable à tout instant s’il y a une urgence) et participe à l’organisation du planning de bloc en appelant le service pour faire descendre le prochain patient à être opéré un peu avant que l’opération en cours ne soit terminée pour limiter le temps de battement. C’est également lui qui noue les casaques de l’équipe de chirurgie avant l’opération.
Quand tout le monde est prêt et habillé l’opération peut commencer.
Dans le cadre de la section de bride de M. X, ce sera un abord cœlioscopique. Le chirurgien pratique une première incision, généralement juste au-dessus de l’ombilic (le nombril). C’est l’incision la plus large car elle doit permettre le passage de l’optique. En dessous de la peau, il existe une membrane extrêmement solide qui s’appelle l’aponévrose. Son incision se fait généralement aux ciseaux (ciseaux de Mayo) ou bien au bistouri électrique (qui utilise l’électricité pour brûler et donc découper les tissus).
L’aponévrose passée, il faut insérer le premier trocart. L’abdomen étant encore plat et l’opérateur n’ayant aucune vision à l’intérieur, l’insertion doit être très prudente afin de ne pas léser un organe. On installe ensuite l’optique dans le trocart et on le relie à une bouteille de dioxyde de carbone qui va permettre de faire gonfler l’abdomen pour laisser plus de place au chirurgien pour travailler (le trocart étant presque hermétique, l’air reste dans l’abdomen).
Les trocarts suivants sont plus fins et insérés après une simple incision cutanée, le chirurgien contrôlant la zone d’insertion de l’intérieur grâce à l’optique.
Si tout va bien, le reste de l’opération est simple et rapide : on tourne un peu dans l’abdomen pour trouver la bride, on la sectionne, on regarde éventuellement s’il n’y a pas d’autres brides que l’on peut sectionner pour éviter de futures obstructions puis on referme et on réveille le patient.
Malheureusement, dans le cas de M. X, ça n’a pas été si simple. Il présentait des signes de souffrance digestive. L’occlusion sur bride, en plus de boucher le tube digestif, a également bloqué la circulation d’une artère chargée de sa vascularisation, occasionnant une nécrose d’un segment de l’intestin grêle. Un segment nécrosé ne pouvant jamais revenir à la vie, il est nécessaire de le retirer. Pour cela, et de la même manière que pour le côlon, on utilise l’agrafeuse (Endo Gia) pour couper le segment nécrosé des deux côtés, puis on réalise une anastomose.
Pour protéger l’anastomose, on met en place une stomie de protection. Concrètement, on fait un trou dans la peau, un trou dans l’intestin grêle en amont de l’anastomose, on ramène le grêle en contact avec la peau et on met des points de suture pour qu’il y reste. Puis, comme expliqué précédemment, on place une poche qui servira de recueil pour les selles.
Il ne reste plus qu’à suturer et mettre des pansements, puis on peut réveiller M. X.
Avez-vous la carte de fidélité ?
Le titre de la partie est volontairement provocateur mais vous allez pouvoir constater par vous-même que, si pour la majorité des patients opérés de l’abdomen les suites opératoires sont simples, pour M. X, ça n’a pas été le cas.
Quelques jours seulement après la résection de sa bride, il a été repris au bloc pour évacuation d’un hématome de paroi. Pour faire simple, l’opération a provoqué un saignement qui s’est manifesté après la fin de celle-ci (ou pendant et que le chirurgien n’a pas vu, mais c’est plus rare). Le sang s’est accumulé et a formé un hématome dans la paroi abdominale qui, au-dessus d’un certain volume, doit être drainé au bloc opératoire afin de pouvoir dans le même temps chercher et arrêter le saignement.
Cette opération a été relativement simple et rapide et M. X a pu sortir une dizaine de jours plus tard. Sa stomie étant temporaire (c’est une stomie de protection qui soulage l’anastomose le temps qu’elle cicatrise), son chirurgien a programmé une opération de rétablissement de continuité (on enlève la stomie et on remet l’ensemble du tube digestif dans l’abdomen) six semaines plus tard.
Et pourtant, c’est seulement 15 jours plus tard que M. X s’est de nouveau présenté aux urgences.
Ça coule
M. X consulte pour anorexie (fatigue généralisée), nausées et vomissements. Des symptômes extrêmement généraux qui peuvent signer un grand nombre d’affections. Au niveau de l’examen clinique, tous les appareils sont normaux. L’abdomen en particulier est souple, dépressible (ça signifie qu’il n’y a pas de résistance à la palpation, laquelle est indicatrice d’une souffrance abdominale) et indolore. La stomie est également très productive, c’est-à-dire que le volume de selles dans la poche est supérieur à ce qu’on s’attend à trouver habituellement.
Il est nécessaire de procéder à des examens complémentaires. Le premier d’entre eux, l’un des plus simples et courant, c’est la biologie. C’est comme ça que l’on appelle l’analyse d’une prise de sang. Voici les analyses les plus fréquentes que l’on demande :
- NFS (ou hémogramme),
- ionogramme,
- CRP (pas toujours fait en routine mais très fréquent),
- Créatinine (idem).
Voyons ensemble ce qu’ils signifient.
Hémogramme
L’hémogramme ou NFS est une quantification et une analyse des trois lignées de cellules sanguines, à savoir :
- les globules rouges (érythrocytes ou hématies) qui transportent le dioxygène,
- les globules blancs (leucocytes) qui combattent les infections,
- les plaquettes (thrombocytes) qui arrêtent les saignements.

Pour les globules rouges, outre leur nombre, ce qui va nous intéresser c’est surtout la concentration en hémoglobine, exprimée en grammes par décilitres de sang. L’hémoglobine c’est la molécule spécifique des hématies qui transporte l’oxygène. Dès qu’il y a une anomalie de cette hémoglobine, on regardera également le Volume Globulaire Moyen (VGM) qui mesure le volume moyen d’un globule rouge en fl (femtolitre, c’est-à-dire un millionième de milliardième de litre) parce que suivant la cause exacte de l’anomalie, l’impact sur le VGM sera différent.
Pour les globules blancs, l’automate va compter chaque sous-lignée : vous pouvez voir les polynucléaires neutrophiles, éosinophiles, basophiles, les lymphocytes et les monocytes. Chacun a son rôle et doit être présent à des concentrations différentes dans le sang.
Pour les plaquettes, on se contente généralement du nombre (le volume plaquettaire est une donnée de spécialiste).
Cet examen est fait sur un prélèvement sanguin veineux et est réalisé par un automate.
Voici les principales anomalies que l’on peut observer :
- le déficit en hémoglobine, aussi appelé anémie (on va en reparler un peu plus loin),
- l’excès de globules blancs, appelé hyperleucocytose, qui indique un syndrome inflammatoire, c’est-à-dire que l’organisme est en train de lutter contre quelque chose,
- le manque de globules blancs ou leucopénie, conséquence dans nombre de situations différentes (VIH, chimiothérapie, etc.),
- l’excès (thrombocytose) ou le manque (thrombopénie) de plaquettes.
Chez M. X, l’hémogramme n’indique aucune anomalie.
Ionogramme
L’ionogramme est une analyse des ions contenus dans le sang. Les trois principaux ions sont :
- le sodium,
- le potassium,
- le calcium.
On s’intéresse aussi plus rarement au phosphore ou au magnésium. Les concentrations en ions dans le sang sont très finement régulées par les reins. Leur excès ou leur manque peut conduire à des troubles très graves (le manque de sodium donne des problèmes cérébraux et le manque de potassium des problèmes cardiaques).
Ici, l’ionogramme de M. X nous indique une hyponatrémie, c’est-à-dire un manque de sodium.
CRP et Créatinine
Le CRP (ou Protéine C-Réactive en français) est un marqueur de l’inflammation. Son augmentation signe un syndrome inflammatoire et s’accompagne assez régulièrement d’une élévation des leucocytes. Chez M. X, la CRP est négative.
La créatinine est un déchet issu des muscles et éliminé par les reins. Son élévation dans le sang au-delà d’un certain seuil montre que les reins peinent à l’éliminer et signe donc une insuffisance rénale. Or, chez M. X, la créatinine est élevée, il souffre donc d’une insuffisance rénale aiguë.
Imagerie
Chez un patient lambda, ces symptômes ne nécessiteraient pas forcément d’imagerie, mais M. X a subi une opération de l’abdomen il y a seulement deux semaines, compliquée d’un hématome post-opératoire. Il y a donc une indication à réaliser un scanner abdomino-pelvien.
Un scanner donne le genre d’image que l’on a vu un peu plus haut et qui nous avait permis de conclure à une occlusion sur bride. Cette fois-ci, le scanner retrouve un petit hématome et un petit pneumopéritoine (de l’air dans le péritoine). Ce sont des séquelles fréquentes après une chirurgie, ils sont de très petite taille et finiront par se résorber tout seul. Les soucis de M. X ne viennent pas de là, on dit que le scanner est non contributif.
Conclusion ?
Nous voilà avec pas mal d’indices, il est temps d’essayer de tout mettre ensemble. Nous avons tout d’abord une stomie qui donne plus de selles que ce qui est attendu. Plus la stomie est haut placée dans l’intestin et plus elle sera liquide et productive (car les selles se durcissent et se condensent surtout dans la partie terminale du tube digestif), il est donc logique d’attendre une quantité importante de selles et très liquides, mais chez M. X, la quantité est vraiment très élevée.
Il est raisonnable de penser que cette hyperproduction stomiale soit la cause de tous nos soucis. Celle-ci a entraîné une déshydratation (car perte d’eau trop importante) et une hyponatrémie. En effet, les selles à cet endroit du tube digestif forment un liquide qui est plus concentré en sodium que le sang, il y a donc une perte de sodium supérieure en proportion à la perte d’eau et une baisse de la concentration en sodium dans le sang, la natrémie.
Pour compenser l’hyponatrémie, le corps absorbe de l’eau dans les cellules afin de réduire le volume circulant et tenter de retrouver une natrémie normale. Ce mouvement d’eau du secteur extracellulaire vers le secteur intracellulaire aggrave la déshydratation, entraîne une hypovolémie (une baisse de volume de sang circulant) qui peut donner de l’hypotension. L’autre conséquence de ces mouvements d’eau c’est que les cellules sont saturées et gonflent, or elles n’aiment vraiment pas et se mettent à dysfonctionner, occasionnant des symptômes comme les nausées, les vomissements, l’asthénie et dans les cas les plus graves, la confusion.
Le corps tente également de compenser l’hyponatrémie grâce aux reins. En quelques mots (parce que c’est un peu compliqué), il va tenter de préserver autant de sodium que possible ce qui peut conduire à des sur-émissions de certaines autres molécules dans les urines et, au contraire, à une incapacité à en éliminer d’autres. Les reins dysfonctionnent, c’est une insuffisance rénale aiguë.
Conclusion : déshydratation sur hyperdébit stomial.
Comment ça se traite ?
Dans le cas de M. X, l’urgence c’est de corriger son hyponatrémie parce que l’hyponatrémie, c’est grave. On va donc réintroduire progressivement du sodium par perfusion. Pourquoi progressivement ? Parce qu’une réintroduction trop brutale risquerait de léser durablement le cerveau, les neurones étant particulièrement sensibles aux variations de la natrémie.
Une fois cela fait, il faut essayer de réduire le débit stomial de façon à contrôler les symptômes et permettre à M. X de rentrer chez lui en attendant son opération de rétablissement de continuité. Pour ce faire, on utilise des médicaments, le premier et le plus connu étant le lopéramide (que vous connaissez peut-être sous le nom d'Imodium).
Cependant, et malgré la dose maximale de lopéramide ainsi que d’autres médicaments à l’effet synergique (introduits et augmentés de manière progressive), nous ne parvenons pas à contrôler le débit de la stomie de M. X. Il fera même deux autres complications au décours de l’hospitalisation (heureusement moins graves qu’une hyponatrémie) : une hypomagnésémie (déficit en magnésium) et une hypokaliémie (déficit en potassium), toutes deux corrigées.
La solution de la dernière chance c’est le passage en nourriture parentérale. Autrement dit, nous allons nourrir M. X par perfusion. Comme les nutriments iront directement dans son sang, ils ne passeront pas par son système digestif qui ne sera pas stimulé et devrait donc se calmer.
Seulement, une poche de nutrition parentérale ne peut pas passer par une veine périphérique (comme la veine du coude qu’on utilise habituellement pour une perfusion) car elle risque de provoquer des caillots. Il faut poser ce qu’on appelle un cathéter veineux central, autrement dit, une voie d’accès vers une grosse veine de l’organisme.
L’un des plus utilisés aujourd’hui s’appelle le PICC Line.
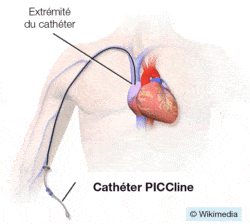
Le geste est généralement pratiqué par un radiologue interventionnel sous contrôle échographique. Il insère le cathéter dans la veine du bras et va remonter doucement jusque dans l’une des deux grosses veines qui alimentent l’atrium droit du cœur : la veine cave supérieure.
Dans le cas de M. X, la nutrition parentérale est finalement parvenue à contrôler le débit stomial (ouf !). Seulement, c’est un type de nutrition qui nécessite une hospitalisation et qui peut entraîner un certain nombre d’effets secondaires, il est donc souhaitable de la retirer le plus vite possible. Pour cela, l’opération de rétablissement de continuité va être avancée.
Retour au bloc
Enfin, nous y sommes : il est temps pour M. X de récupérer le plein fonctionnement de son tube digestif et de se débarrasser de sa stomie.
L’opération n’est pas une cœlioscopie mais n’est pas vraiment une laparotomie non plus. On ne va pas réouvrir M. X, on va se contenter d’utiliser l’orifice de stomie existant.
Une fois la poche de stomie enlevée, la première étape c’est de libérer le tube digestif de la surface de la peau. En effet, souvenez-vous : quand nous avons réalisé la stomie, nous avons ramené l’intestin grêle au niveau de la peau et nous les avons fixés ensemble avec du fil de suture. Il y a ainsi eu formation d’adhérences entre ces deux structures qu’il faut couper pour pouvoir refouler le tube digestif à l’intérieur de l’abdomen.
Une fois cela fait, on recoud le trou que l’on avait fait dans l’intestin puis celui que l’on avait fait dans la peau pour que les selles s’écoulent dans la poche. Ça paraît simple et à vrai dire, dans la plupart des cas ça l’est. Mais malheureusement, pas dans celui de M. X.
Les adhérences sont très nombreuses. Trop nombreuses. Le chirurgien ne parvient pas à tout libérer par le seul trou de stomie. Il prend donc la décision de laparo-conversion. Il va pratiquer une incision médiane, c’est-à-dire une longue ouverture verticale au milieu de l’abdomen qui contournera seulement le nombril. À partir de là, il a accès à l’intégralité de l’abdomen et la libération de l’intestin puis la suture des orifices de stomie est beaucoup plus facile.
Seulement, avec toutes les complications qu’il a enchaînées, l’organisme de M. X est fragile et l’opération le fait beaucoup saigner. La phase d'hémostase (arrêt des saignements provoqués par la manipulation chirurgicale) sera longue et plutôt délicate. Cela nécessitera la pose de deux drains, des dispositifs qui recueillent dans une poche le sang qui exsude des organes le temps qui ceux-ci cicatrisent.
L’opération aura duré 4h contre environ 2h habituellement. Cela dit, maintenant que la continuité est rétablie, on pourrait penser tout va rentrer dans l’ordre. C’est bien mal connaître M. X.
Suites et fin
Pour désigner ce qui se passe les quelques jours voire semaines après une chirurgie, on parle de suites opératoires. Habituellement, ces suites sont simples mais - et je pense que vous commencez à me voir venir - pas dans le cas de M. X.
Le lendemain de l’opération, le patient a très mal et sur le bilan biologique de contrôle, son hémoglobine (le constituant des globules rouges qui transporte le dioxygène) est à 4.5 g/dl alors que le normale pour un homme adulte est entre 13 et 18 (l’hémogramme que je vous ai montré un peu plus haut était celui d’une femme, d’où la norme un peu plus basse). C’est très peu.
Ce déficit en hémoglobine est une anémie.
D’où vient l’anémie ?
Les causes d’anémie sont extrêmement nombreuses et il est nécessaire de savoir à laquelle on a à faire avant d’essayer de la corriger.
La plupart des anémies sont progressives, une anémie aussi brutale laisse le choix entre deux diagnostics principaux :
- post-hémorragie aiguë. Quand on saigne, on perd du sang global, l’anémie (qui est une concentration d’hémoglobine dans le sang) ne varie donc pas : on perd du volume, mais les concentrations restent les mêmes. Cependant, dans un second temps (dans les heures qui suivent), le corps remplit les vaisseaux sanguins avec de l’eau par divers mécanismes (sensation de soif intense, rétention rénale, passage d’eau du secteur intracellulaire au secteur extracellulaire, etc.) en revanche, les globules rouges mettent beaucoup plus de temps à se régénérer (3 à 5 jours). Il y a donc dilution des globules rouges dans le sang et apparition d’une anémie.
- hémolyse aiguë : le corps détruit les globules rouges. Ça peut avoir plusieurs origines : auto-immun (l’organisme produit des anti-corps déficients qui attaquent les globules rouges), infectieux (paludisme), etc.
Pour M. X, il n’y a pas de raison qu’il ait une hémolyse, en revanche, suite à une opération (et encore plus si on tient compte des saignements pendant celle-ci), l’hypothèse de l’hémorragie est très probable.
Dans la population générale, cette hypothèse donne une indication à la coloscopie (on fait pénétrer un endoscope, c’est-à-dire une caméra prolongée d’un câble souple dans l’anus d’un patient puis on remonte le rectum jusqu’au côlon voire l’intestin grêle) parce qu’on va chercher un saignement du tube digestif. Toutefois, M. X. a des antécédents de chirurgie compliquée, en première intention on va donc chercher un saignement intra-abdominal et cette recherche passe par le biais d’un scanner.
L’imagerie montre un hémopéritoine important, c’est-à-dire que le péritoine est rempli de sang.
Traiter l’anémie
Pour arrêter le saignement, il va falloir réopérer, mais avec son hémoglobine effondrée, M. X est très instable et ce n’est pas une bonne idée de l’opérer en l’état : il va falloir compenser son anémie à l’aide d’une transfusion sanguine de CGR (aussi appelés culots globulaires).
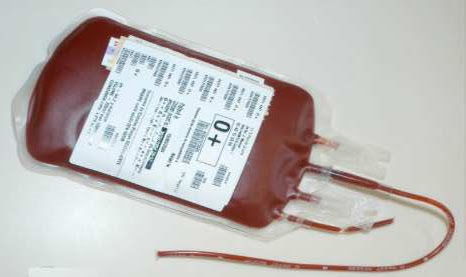
Quand vous faites un don du sang, les différents éléments qui composent votre sang sont séparés :
- les globules blancs sont éliminés,
- les globules rouges sont rassemblés dans des CGR,
- les plaquettes ne sont pas assez nombreuses dans un don de sang complet pour être transfusées seules, on les regroupe avec 6 à 8 autres prélèvements pour former un concentré plaquettaire,
- le plasma (la phase liquide du sang, sans les cellules) peut-être transfusé directement ou envoyé vers le Laboratoire français du Fractionnement et des Biotechnologies (LFB) qui l’utilise pour produire certains médicaments, notamment à base d’immunoglobulines.
Pour transfuser un patient, il est absolument nécessaire de lui donner un CGR avec lequel il soit compatible. Vous avez sans doute déjà entendu parler de donneur et de receveur universel, de groupe ABO et de rhésus.
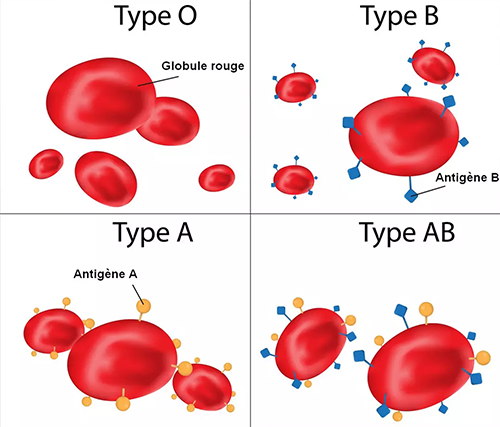
Tout cela repose sur les antigènes et les anticorps. Les antigènes qui nous intéressent sont des glucides ou des protéines à la surface des globules rouges. Il existe plusieurs versions de ces antigènes et notre corps est configuré pour être tolérant et ne pas attaquer les globules rouges qui possèdent des antigènes avec lesquels nous naissons (heureusement). Mais si vous donnez à un patient des globules rouges qui contiennent des antigènes étrangers, vous risquez une réaction immunitaire grave.
Aujourd’hui, on recense environ 380 antigènes différents répartis dans 43 systèmes. Par exemple ABO (le plus connu) est un système composé de 2 antigènes (A et B) ou d’une absence d’antigène (O). Un patient peut être A, B, AB ou O. En routine, on explore 14 antigènes appartenant à 6 systèmes.
Le rhésus est un autre système, il comporte 56 antigènes différents mais on n’en cherche que 5 en routine. Le plus connu est l’antigène D (ou RH1) qui est historiquement celui qui donne un rhésus positif (si on possède l’anticorps) ou un rhésus négatif (si on ne possède pas l’anticorps).
Pour les systèmes ABO et RH, tout patient ne possédant pas un antigène va produire des anticorps contre ces antigènes :
- un patient du groupe B aura des antigènes B mais pas de A et va donc produire des anticorps anti-A,
- à l’inverse, un patient du groupe A va produire des anticorps anti-B,
- un patient du groupe O n’a pas d’antigène ni A ni B, il va donc produire des anticorps anti-A et anti-B,
- un patient du groupe AB a des antigènes A et des antigènes B, il ne va produire aucun anticorps,
- un patient RH1+ (rhésus positif) a des antigènes D et ne produira pas d’anticorps contre, mais un patient RH1- produira des anticorps anti-D.
Si vous donnez du sang d’un donneur du groupe B a un receveur du groupe A, les anticorps anti-B du receveur vont attaquer les antigènes B du sang du donneur et provoquer une réaction immunitaire. Le système ABO et l’anticorps D du système RH sont très immunogènes, c’est-à-dire qu’ils provoquent des réactions graves, il est donc absolument essentiel de les respecter.
Quand on transfuse des globules rouges, les patients de groupe O- sont donneurs universels car leurs globules rouges ne contiennent aucun antigène (au sens ABO et RH1), personne n’aura de réaction à leur contact, quel que soit le groupe. A contrario, un patient AB+ est receveur universel puisqu’il ne possède aucun anticorps, il peut donc recevoir du sang en provenance de n’importe qui.
Quand on transfuse du plasma, c’est la règle inverse qui s’applique puisqu’on ne transfuse plus des globules rouges contenants des antigènes qui risqueraient d’être attaqués par le système immunitaire du receveur, mais du plasma contenant des anticorps qui risqueraient d’attaquer les globules rouges du receveur. Le plasma AB+ ne contient aucun anticorps, il peut donc être transfusé à tous les patients. Le plasma O- contient des anticorps anti-A, des anti-B et des anti-D, il ne peut donc être transfusé qu’à des patients O- mais peut recevoir du plasma de n’importe qui.
Il existe d’autres antigènes : C, c, E et e appartenant au système rhésus ainsi que KEL1 appartenant au système KEL. Ces antigènes sont moins importants et on ne les respecte que pour les patients à risque : les femmes enceintes et les patients polytransfusés. Il existe encore d’autres antigènes cherchés en routine, mais peu importants pour la transfusion sanguine.
On voit le bout
M. X va repasser au bloc une nouvelle fois, 2 jours après son rétablissement de continuité. Il sera rouvert au niveau de la laparotomie médiane de sa précédente opération (la cicatrisation n’étant pas terminée, ça permet d’éviter de faire une autre incision). L’opération est plutôt simple : il faut trouver le ou les saignements, les arrêter et vider l’abdomen du sang qui s’est accumulé.
Pour M. X, c’est enfin la dernière opération. Son hémoglobine est remontée aux alentours de 9 (ce qui est peu, mais tolérable). Pour accompagner la synthèse de nouveaux globules rouges par l’organisme, on réalisera une injection de fer.
En effet, le fer est un élément essentiel de l’hémoglobine et l’organisme n’en a pourtant que de petites réserves qui ont vite fait de s’évaporer en cas d’hémorragie.
Trois jours après la dernière opération, il reprend un transit. En effet, après une chirurgie abdominale, le tube digestif se sent agressé et se met au repos (c’est ce qu’on appelle un iléus) pendant quelques jours. C’est une forme d'occlusion fonctionnelle, comme ce que nous avons eu plus haut. Le retour des selles et des gaz marque la fin de l’iléus. On peut arrêter la nutrition parentérale et reprendre progressivement la nutrition orale : des liquides et des aliments moulinés d’abord, puis de la nourriture normale si tout se passe bien. M. X a perdu beaucoup de poids pendant son hospitalisation (près de 7kg) alors qu’il n’était déjà pas bien gros à la base, il bénéficiera également d’un complément protéique.
Enfin, quelques jours plus tard, on enlèvera les drains qui ne recueillent presque plus de liquide (signe que l’intérieur de l’abdomen est en train de cicatriser complètement) et M. X va pouvoir rentrer chez lui tranquillement.
La chirurgie n’est pas qu’une difficulté technique : il est également indispensable d’avoir en tête les complications possibles et la façon de les prendre en charge. Ici nous n’avons exploré que des complications relativement simples et de la seule chirurgie digestive. Parfois, les complications possibles sont tellement graves que l’on renonce à l’opération, quand bien même le geste en lui-même n’est pas si difficile.
En complément, je vous propose la dernière vidéo de Primum Non Nocere (qui est sortie pendant que j’écrivais cet article après quasiment 3 ans sans vidéo, si ça c’est pas un signe) qui traite de la chirurgie et notamment de la difficulté de l’apprendre et de la pratiquer.
Enfin, un grand merci à @Gabbro pour la validation !
Sources :
- Anatomie du tube digestif : https://fr.wikipedia.org/wiki/Appareil_digestif_humain.
- Cancer colique : Cancérologie, 3e édition, R2C, par le Collège National des Enseignants en Cancérologie, éditions Med-Line.
- Chirurgie digestive : Chirurgie générale, viscérale et digestive, 3e édition, R2C, coécrit par le Collège Français de Chirurgie Générale, Viscérale et Digestive et le Conseil National des Universités de Chirurgie Générale, Viscérale et Digestive, éditions Med-line.
- Occlusion sur bride : Hépato-gastro-entérologie Chirurgie Digestive, 4e édition, par la Collégiale des Universitaires en Hépato-Gastro-Entérologie, éditions Elsevier Masson.
- Hémogramme, anémie et transfusion : Hématologie, 4e édition, R2C, par la Société Française d’Hématologie, éditions Elsevier Masson.
- Hyponatrémie : Néphrologie, 9e édition, R2C, par le Collège Universitaire des Enseignants de Néphrologie, éditions ellipses.







