Bonjour à tous,
Puisque jamais deux sans trois, je vous soumets à nouveau une question en chimie  . Encore une fois, il s'agit d'un problème basique1 que j'ai du mal à résoudre. Mais rentrons dans le vif du sujet.
. Encore une fois, il s'agit d'un problème basique1 que j'ai du mal à résoudre. Mais rentrons dans le vif du sujet.
On présente la molécule suivante :
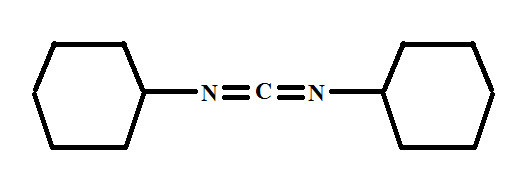
Le sujet affirme que les doublets non-liants des atomes d'azote sont perpendiculaires et, là, je en comprends pas comment on peut le constater. Plus généralement, comment peut-on identifier la géométrie d'une molécule à partir des types orbitalaires ?
Pour le moment, voici jusqu'où va mon raisonnement : avec un doublet non-liant et deux atomes voisins, les azotes sont hybridés sp2. Ces atomes ont donc 3 orbitales sp2 et 1 orbitale p : le doublet non-liant est donc dans une orbitale sp2, puisque la p est impliquée dans la liaison avec C. D'autre part, l'hybridation sp2 renseigne sur la géométrie : les liaisons de l'azote adopteraient donc une disposition trigonale plane.
Mais ça ne me dit pas pourquoi les doublets sont perpendiculaires.
Bref, merci d'avance pour vos réponses,
Dwayn
-
au sens commun du terme, hein. ↩

 . En tout cas, ton message éclaircit pas mal la chose. Mais je n'arrive pas à intégrer pourquoi les orbitales p devraient être perpendiculaires.
. En tout cas, ton message éclaircit pas mal la chose. Mais je n'arrive pas à intégrer pourquoi les orbitales p devraient être perpendiculaires.
