Bonjour à tous,
Je sais qu’il n’y pas beaucoup de chimistes sur le forum et encore moins de fans de chimie organique mais je teste pour voir, on sait jamais ! 
La synthèse d’une molécule peut être parfois complexe surtout si l’on veut proposer une voie de synthèse réaliste au laboratoire. C’est uniquement avec de l’entrainement qu’on peut y arriver donc c’est très utile 
RÈGLES
C’est très simple! Je commence à proposer une enigme et puis celui qui la résous en propose une autre. Une solution possible sera postée quand il y aura quelques réponses, de préférence une semaine après. Si aucune réponse n’apparait, on peut bien sûr donner un indice! Tentez simplement de proposer la voie de synthèse la plus réaliste possible sans avoir trop d’étapes!
Comme dans un "vrai laboratoire", ça serait sympa de ne pas imposer de produit de départ mais simplement le produit final et de choisir soit même le produit de départ en passer par des sites comme Sigma où vous trouverez un produit de départ idéalement pas trop cher et tout 
Comme première molécule à synthétiser, je propose la synthèse de l’ibuprofène.
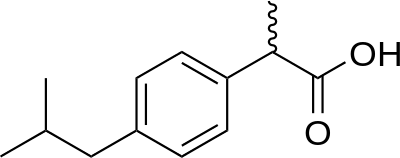
Bonne chance et j’espère qu’il y aura quelques personnes qui joueront le jeu 


 j’aime le détail
j’aime le détail 
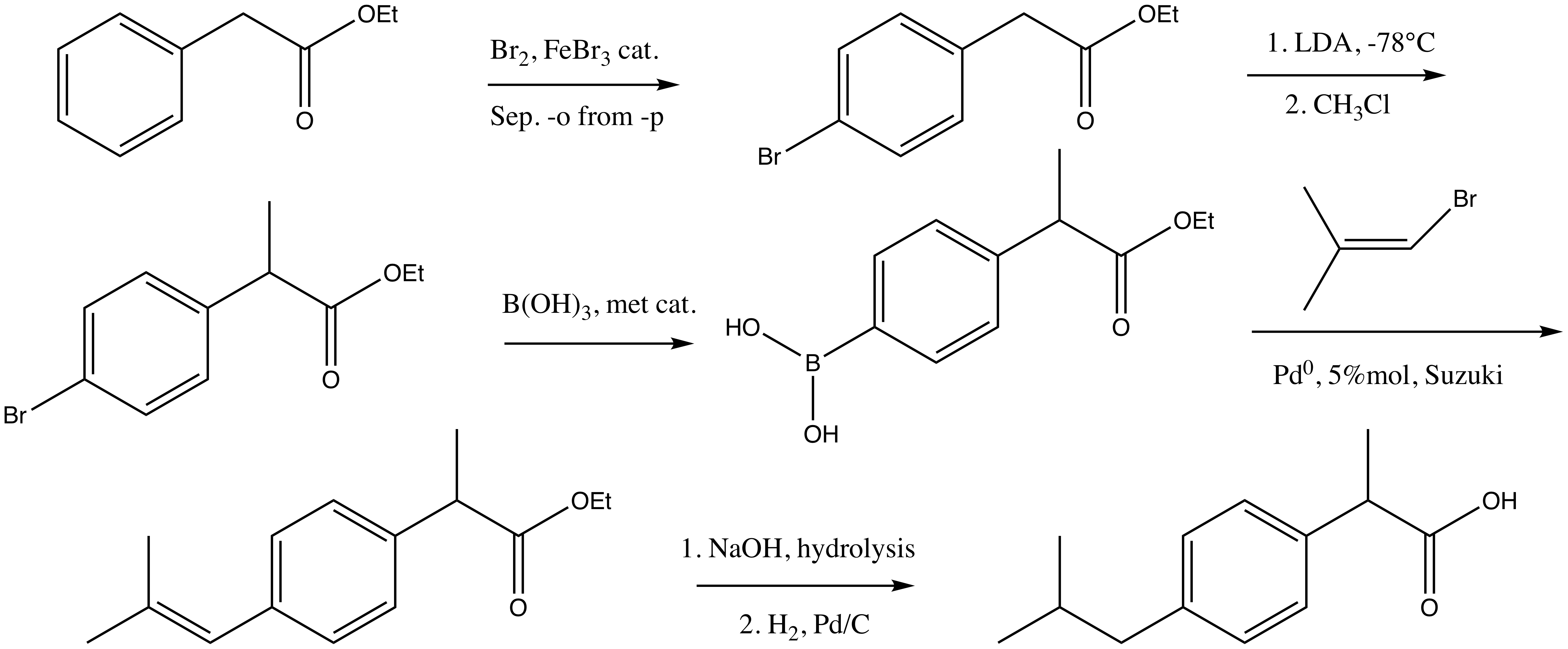

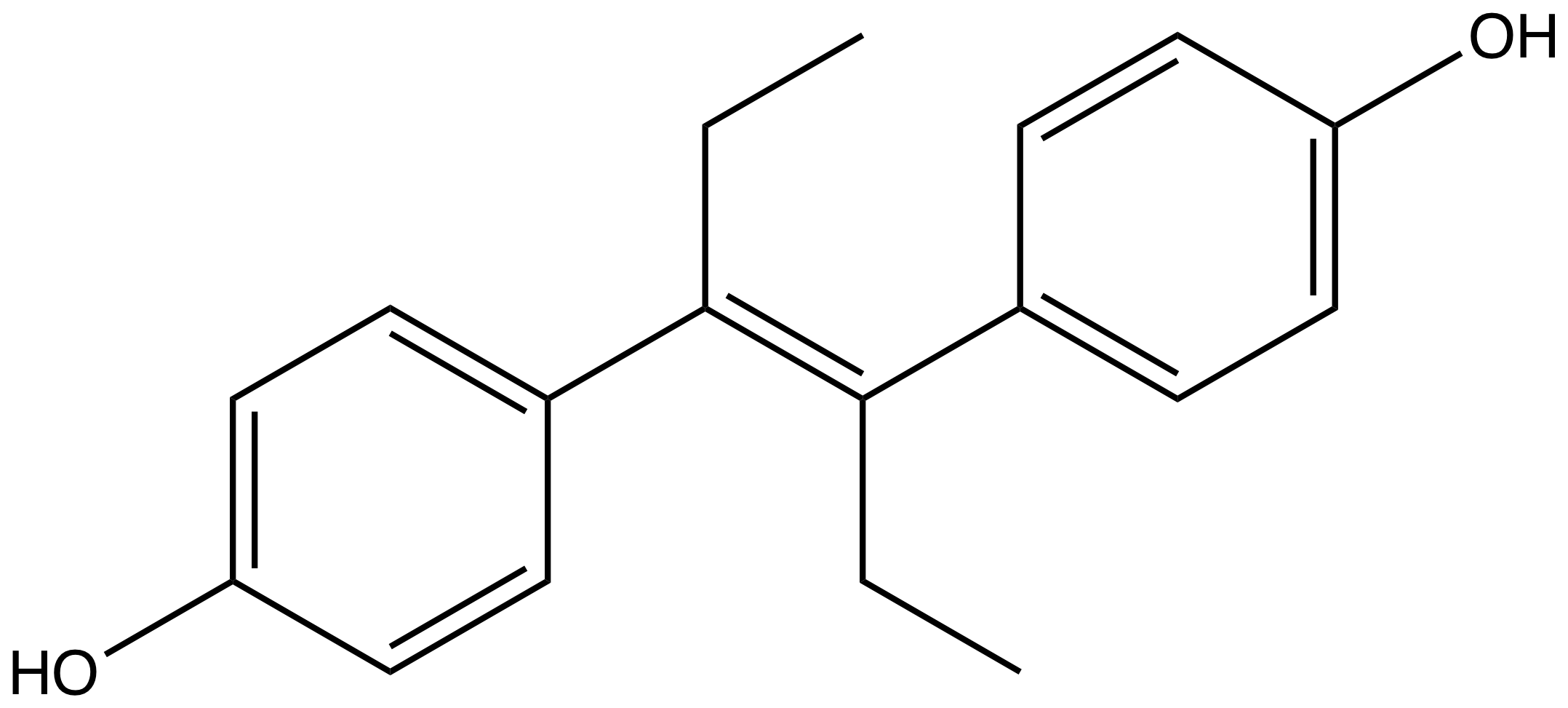

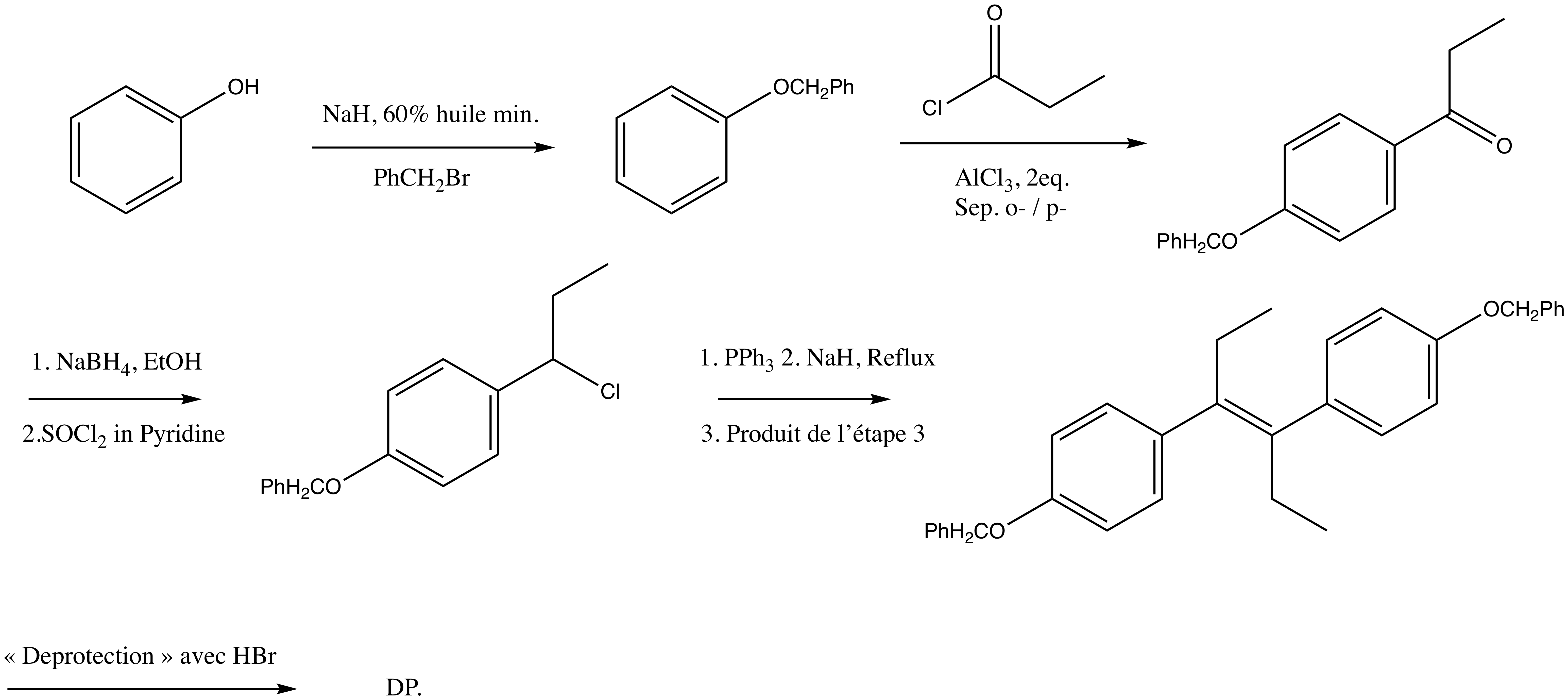
 stpp
stpp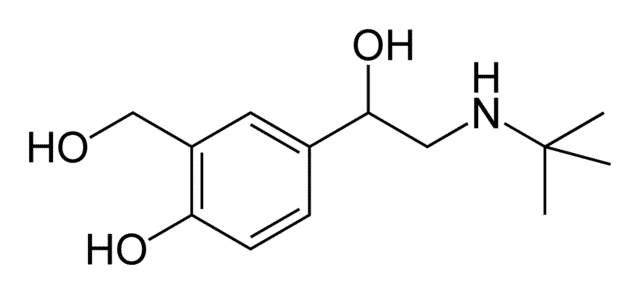
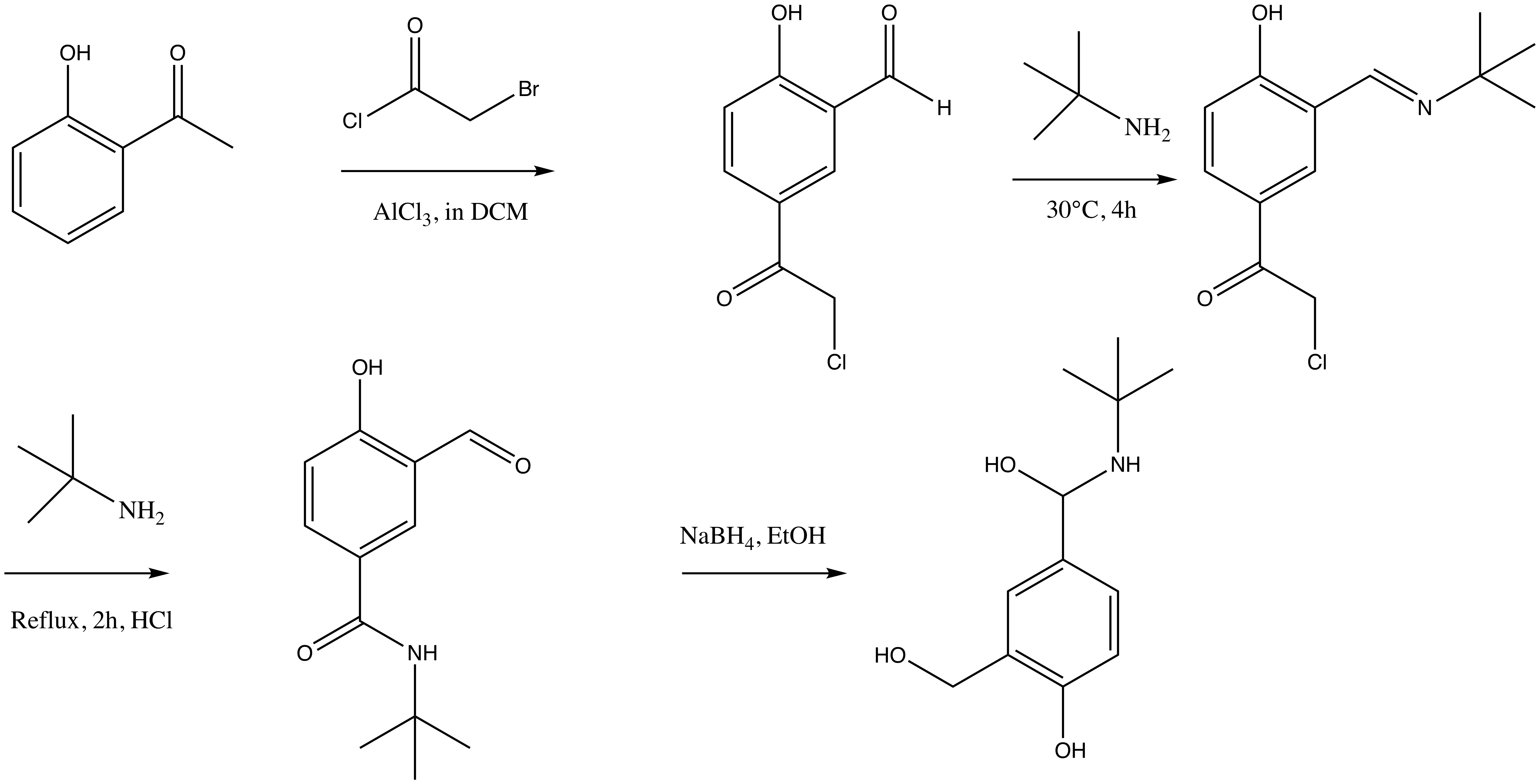


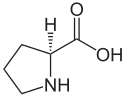
 en suivant les règles standard de nomenclature, faut pas tout mélanger.
en suivant les règles standard de nomenclature, faut pas tout mélanger. 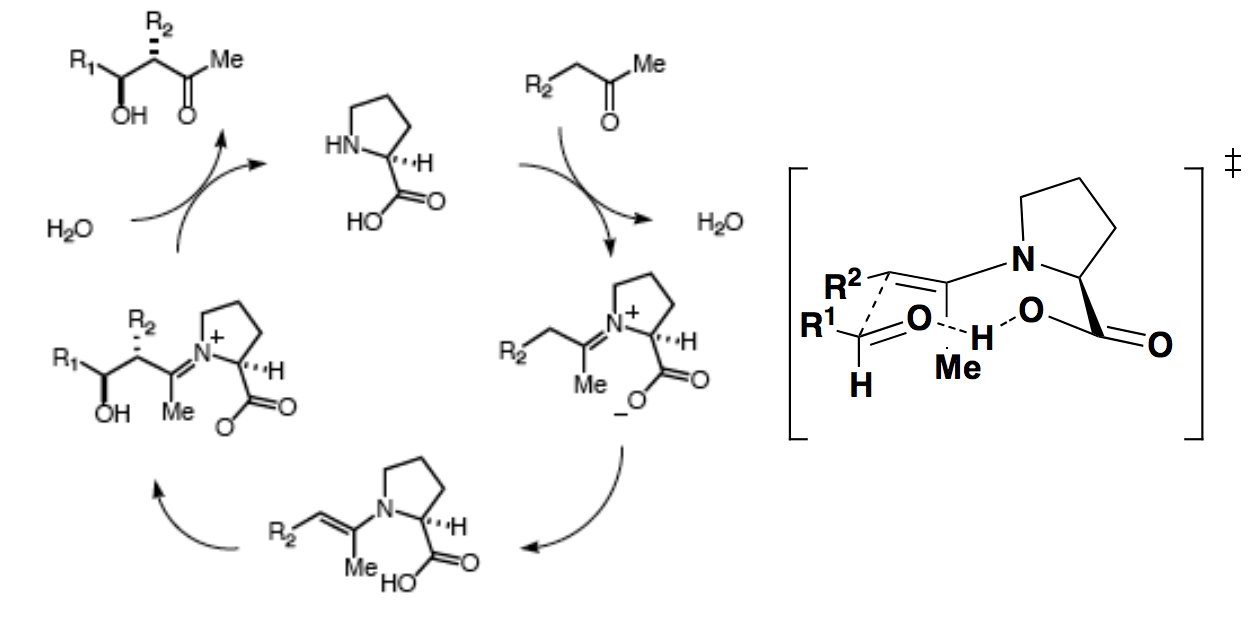
 Mais j’ai lu quelques livres dessus et c’est vachement intéressant… Pleins de choses à faire encore là-dedans!
Mais j’ai lu quelques livres dessus et c’est vachement intéressant… Pleins de choses à faire encore là-dedans!