Edit: Grillé par pierre_24, mais j'ai mis du temps à rédiger donc je poste en l'état (espérons que ça concorde avec ce qu'il dit!). 
J'ai finalement eu le temps de lire tout ça, merci beaucoup pour les explications.
Merci d'avoir lancé le sujet, c'est intéressant! 
1) À propos des orbitales moléculaires (je me suis arrêté aux orbitales atomiques dans mon cours, donc c'est peut-être évident), est-ce que l'orbitale g a une énergie plus basse que celle u pour sigma (le contraire pour pi) de manière systématique, ou y a-t-il un moyen pour le savoir ?
La logique est la suivante:
-
Les orbitales liantes sont toujours plus basses en énergie que les anti-liantes (normal, ce sont les liantes qui forment les liaisons!). Donc
$\sigma$ est plus basse en énergie que$\sigma$ * et$\pi$ est plus basse que$\pi$ *. Ceci est indépendant de g et u! (d'ailleurs comme tu l'as justement remarqué, les liantes$\sigma$ sont g tandis que les liantes$\pi$ sont u) -
Concernant g et u, c'est une convention qui découle de la forme des orbitales. Si l'orbitale possède un centre d'inversion (point rouge sur mon dessin), elle est g (de l'allemand gerade) et sinon u (ungerade):
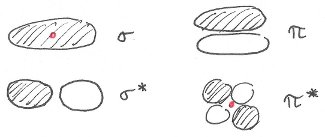
2) Je ne comprends pas pourquoi les deux excitations sont dans ce sens. D'après le diagramme, la 2ème demande moins d'énergie que la première. Comment sont-elles classées si ce n'est par l'énergie ?
Attention à l'utilisation du mot excitation. Pour faire simple, le mot excitation veut dire passage d'un état à un état plus haut en énergie.
Les états (c'est-à-dire les différents arrangements d'électrons) sont classés par énergie (X est l'état fondamental, A est un peu plus haut en énergie, etc). Quant aux transitions (mouvement d'un électron vers le haut ou vers le bas, qui de fait fait passer la molécule d'un état à un autre), j'ai écrit au hasard C

