Bonjour à tous les copains scientifiques.
Me préparant à passer l’agrégation de chimie un d’ces jours, j’me dis que ça serait cool d’avoir votre avis/aide concernant la rédaction des réponses et les voies de réflexions. Aussi m’aider là où je n’ai pas trouver de réponse cohérente ou autre.
Pour présenter un peu la chose qu’est-ce que l’Agrégation ?
C’est un concours Français de niveau Bac +5 (Master) qui est assez réputé par sa sélectivité. Après avoir fait 5 années à l’ENS ou après avoir fait un master dédié à la préparation à l’agrégation on peut passer ce fameux concours. Au quel cas on reçoit le titre d’agregé si le classement le permet et il est possible de devenir enseignant. Les postes alors disponible sont entre le secondaire jusqu’au debut universitaire (Prépa, DUT, BTS, LP)
Qu’est ce qu’un concours ? Quelles sont les particularités ?
Un concours est particulier dans le sens où c’est le nombre de place disponible et la mouture de la promotion de l’année qui créer une "moyenne" une note "d’admissibilité". Il y avait en $2016$, $40$ place pour $677$ candidat. Seulement $82$ ont été admissible (réussite des écrits, passage à l’étape finale (un oral)) avec pour note la plus basse $9.21$ aux écrits.
Donc la note à obtenir à l’agrégation 2016 pour être admissible était de $9.21$, c’est un cas particulier. En $2015$ par exemple la note minimale était de $11.23$.
En bref peu de place, peu de réussite, un concours réputé pour être chaud
Là en essayant de le faire en utilisant le moins internet (c’était en décembre), je me suis heurter à un problème cinétique que je n’arrive pas à résoudre. C’est à la fin de ce post, si vous voulez directement m’aider là où ça bloque.
Je vais donc commencer à rédiger les réponses à l’Agregation de chimie 2016 (lien PDF de l’épreuve A) qui me semblent correcte et j’attend vos retours.
Autour du Binol
I. Etude Structurale du BINOL
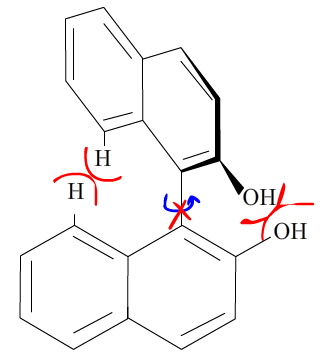
1) Représenter le $(R)\text{-(+)-BINOL}$ 1. Indiquer ce que signifie le préfixe (−) et décrire de manière claire et concise la manière dont il est déterminé. De même, expliciter l’attribution du stéréodescripteur $(S)$.
Là j’ai eu de la veine, j’ai déjà posé pas mal de questions sur cette molécule et mathiasm m’avait pas mal aidé à comprendre comment se nommer les atropoisomères.
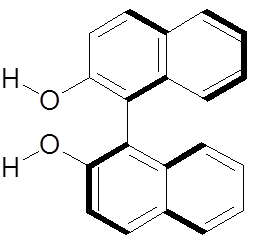
Le préfixe (-) (dans la molécule $S\text{-(-)-BINOL}$) signifie que la propriété chiroptique de la molécule dévie le plan de polarisation de la lumière vers la gauche (donnant ainsi un pouvoir rotatoire négatif). Le descripteur de configuration (-) est équivalent au descripteur $\ell$ signifiant levogyre : qui devie le plan de polarisation vers la gauche.
La molécule ayant un pouvoir optique est mis en solution dans un solvant (souvent du chloroforme, mais ici du THF) pour être analysé dans un polarimêtre. Ce dernier (à l’aide d’un filtre polarisant et d’un analyseur (filtre polarisant pouvant s’orienter)) permet d’obtenir le pouvoir optique de la molécule de manière expérimentale. Suivant la loi de Biot :
A noter que cette équation permet de remonter à la concentration en espèce $R$ ou $S$ renseignant ainsi sur la pureté optique du composé analysé.
Dans un cas d’atropoisomérie (comparable aux allènes) il faut représenter la molécule selon l’axe 1 – 1’. Une fois que les ordres de priorités sont definis (par le protocole Cahn-Ingold-Prelog) alors on peut assigné un stéréodescripteur à la molécule. Pour le S-(-)-BINOL par exemple :
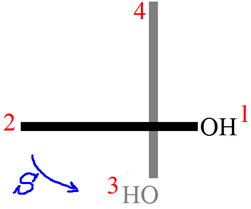
2) Rappeler la définition d’une entité chirale, et proposer deux exemples de molécules chirales présentes énantiomériquement pures dans la nature.
Une molécule chirale est une molécule possédant un centre stéréogène ainsi qu’aucun plan de symétrie en son sein. Ou bien un molécule ayant (de près ou de loin) une topologie proche d’une spirale (voir complexe de coordination avec une symétrie $\Lambda$/$\Delta$ et les Hélices d’ADN ou d’anthracène)
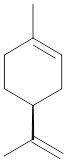
Cette molécule est l’énantiomère S du limonène, son obtention est simple car cette molécule est biosynthétisée par les agrumes (orange, citron…). Certaines espèces donnent lieu à un mélange des deux énantiomères et certaines donnes le composé de forme énantiopure. Il diffère de son homologue le R-limonène par le changement de la position relative du groupe isopropènyle.
3) Préciser le sens de l’expression « chiralité axiale ». Indiquer de quel type de stéréoisomérie il s’agit. Donner un autre exemple de molécule présentant une chiralité axiale.
La chiralité axiale énoncée ici est un phénomène d’atropoisomèrie. La molécule est bloquée dans un conformère particulier et à cause d’une rotation impossible le rotamère est ainsi un isomère stable et discernable de son énantiomère.
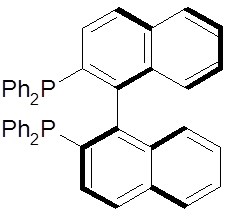
Le $BINAP$ est une molécule possédant les mêmes caractéristique que la BINOL (deux cycle naphtalènique branché par le carbone $\alpha-\alpha'$), les groupements hydroxyles sont juste remplacés par des diphénylphosphines, très encombrantes entravant ainsi la rotation libre de l’axe $1–1’$.
L’étude expérimentale de la vitesse de racémisation du $(S)\text{-(−)-BINOL}$ $1$ s’effectue selon le protocole suivant : une solution de $25\;\text{mg}$ de $(S)\text{-(−)-BINOL}$ $1$ dans le diphényléther est placée dans un tube à essai et chauffée à $220°\text{C}$ à l’aide d’un bain d’huile. À intervalles de temps réguliers, un échantillon de solution est analysé par chromatographie en phase gaz sur phase stationnaire chirale pour déterminer l’excès énantiomérique du $BINOL$. Les résultats sont présentés dans le tableau ci-dessous.
4) Sachant que l’excès énantiomérique d’un composé énantiomériquement pur est de 100% et celui d’un mélange racémique est de 0%, déterminer les proportions des énantiomères présents dans le mélange à l’instant initial. Commenter.
Le nombre de moles initiales $n_{(S_{ini})} = S' = \frac{m}{M} = \frac{0.025}{286} = 8.75 \cdot 10^{-5}\;\text{mol}$ Or au vue de l’excès énantiomérique on peut s’attendre à ce qu’il y ait déjà un produit de racémisation qui soit apparu car :
On constate avec cette démarche que le produit de dégradation $(R)$ n’est présent que très minoritairement ($\sim 3 \% $), comme l’$\text{ee}$ le laisse présumer. Le résultat est donc en accord avec l’excès énantiomérique.
5) Determiner la valeur de l’excès énantiomérique au bout d’un temps très grand.
Une racémisation tend à former un racémate, ce dernier est un mélange de 2 énantiomères en proportions égales, ainsi l’$\text{ee}$ serait égal à $0$.
6) A l’aide d’un modèle cinétique approprié, proposer une loi de vitesse rendant compte de l’évolution temporelle de l’excès énantiomérique et determiner la valeur de la constante de vitesse de la réaction de racémisation, ainsi que du temps de demi-réaction associé, à $220°\text{C}$
C’est là où je bloque, je ne trouve pas l’ordre de la réaction… Donc je ne trouve pas de modèle de loi de vitesse. J’suis vraiment NOOB pour le coups :
Rappel :
Avec les différentes constantes à l’ordre $0$, $1$ ou $2$
Je ne trouve aucune valeur de $k_i$ qui soit constante réellement, bien sûr il y a $k_0$ qui ne varie pas énormément, mais c’est compte tenu de son ordre de grandeur je pense. Si quelqu’un avait un indice pour m’aider à trouver l’ordre de la loi cinétique de cette racémisation ? Ça pourrait m’être ultra utile.
Merci pour votre lecture de ce début d’un grand projet, j’essayerais de faire en sorte que ce post devienne le plus complet possible.